
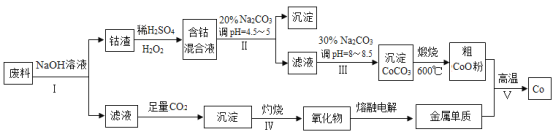
【题目】钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3 和Fe2O3等物质)。
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________(填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
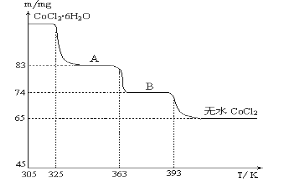
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________。
【答案】增大反应物接触面积,加快反应速率 Co2O3+H2O2+4H+=2Co2++ O2+3H2O Co2O3可氧化盐酸产生Cl2,污染环境 2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑ 坩埚 3CoO+2Al
+3H2O=2Fe (OH)3↓+3CO2↑ 坩埚 3CoO+2Al![]() 3Co+ A12O3 1.0×10-9 CoCl2·2H2O
3Co+ A12O3 1.0×10-9 CoCl2·2H2O
【解析】
第一步中,Al和氢氧化钠溶液反应,其离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,得到滤液和滤渣,因此采用操作步骤是过滤,滤液中AlO2-与二氧化碳反应得到氢氧化铝沉淀,之后灼烧并通过电解熔融氧化铝得到金属单质铝。滤渣中Co2O3作氧化剂与过氧化氢反应,化合价由+3价→+2价,之后调节PH得到Fe(OH)3。滤液中Co2+不能转化成沉淀,根据pH的范围为3.2≤pH<7.15调节PH得到碳酸钴沉淀之后进行煅烧得到氧化钴,与金属单质铝发生铝热反应得到金属单质Co。根据此分析进行解答。
(1)废料进行矿石粉碎处理,可以增大接触面积,加快反应速率,
故答案:为增大反应物接触面积,加快反应速率
(2)Co2O3作氧化剂与过氧化氢反应,化合价由+3价→+2价,故反应的离子方程式为Co2O3+H2O2+4H+=2Co2++ O2+3H2O。HCl被氧化后,Cl由-1价→0价,反应离子反应方程式为Co2O3+2Cl-+6H+=2Co2++3H2O+Cl2↑,会产生氯气污染环境,
故答案为:Co2O3+H2O2+4H+=2Co2++ O2+3H2O Co2O3可氧化盐酸产生Cl2,污染环境
(3)在过程Ⅱ中Fe3+与碳酸根发生双水解,转化成Fe(OH)3,但Co2+不能转化成沉淀。碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式为2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑,
+3H2O=2Fe (OH)3↓+3CO2↑,
故答案为:2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑
+3H2O=2Fe (OH)3↓+3CO2↑
(4)过程Ⅳ是将Al(OH)3 灼烧生成Al2O3,需要在坩埚中进行,电解熔融氧化铝得到金属单质铝,过程Ⅴ中氧化钴与金属单质铝发生铝热反应得到金属单质Co,化学方程式为3CoO+2Al![]() 3Co+ A12O3,
3Co+ A12O3,
故答案为:坩埚; 3CoO+2Al![]() 3Co+ A12O3
3Co+ A12O3
(5)Co2+与CO32-结合成CoCO3沉淀,此时碳酸根的浓度为(1.2×10-3-1.0×10-3)÷2=1×10-4,故Co2+的浓度=![]() mol/L,
mol/L,
故答案为: 1.0×10-9
(6)由图可知n(CoCl2)=65×10-3÷130=5×10-4mol,物质A中含有的结晶水的物质的量为n(H2O)=(83-65)×10-3÷18=1×10-3mol,故n(CoCl2)∶n(H2O)=1:2,故物质A的化学式为CoCl2·2H2O,
故答案为:CoCl2·2H2O


科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B___;C___;E___
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①___;④___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是

A. a中含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
B. b分子存在属于芳香族化合物的同分异构体
C. c分子中所有碳原子可能处于同一平面
D. a、b、c均能发生加成反应、取代反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:

(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是____。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是_____。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是____。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(l) ΔH1<0
Si(s) + 2ZnCl2(l) ΔH1<0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(g) ΔH2<0
Si(s) + 2ZnCl2(g) ΔH2<0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)![]() Si(s) + 2ZnCl2(g) ΔH3<0
Si(s) + 2ZnCl2(g) ΔH3<0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是____。
③ 已知Zn(l)=Zn(g) ΔH = +116 KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =________。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
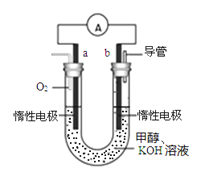
①该电池工作时,负极是_______极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为_________________。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)![]() 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
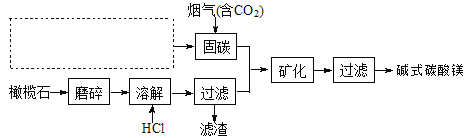
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为_____________。
②在上图虚框内补充一步工业生产流程______________。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列有关问题.
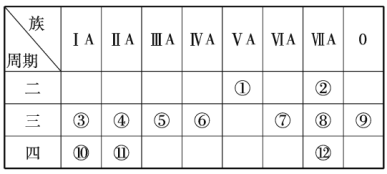
(1)写出下列元素符号:①______,⑥______,⑦______,______.
(2)这些元素中最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的氢氧化物是______,写出三者之间两两反应的化学方程式:______;______;______.
(4)这些元素(除0族元素外)中原子半径最小的是______(填元素符号,下同),原子半径最大的是______.
(5)在③与④中,单质的化学性质较活泼的是______(填元素符号),怎样用化学实验证明?______在⑧与中,单质的化学性质较活泼的是____________(填元素符号),怎样用化学实验证明?_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有几种元素的微粒的电子层结构为 ,试回答下列问题:
,试回答下列问题:
(1)若该微粒代表一种原子,则这种微粒的符号是______;
(2)向该微粒(带负电荷)的盐溶液中加入![]() 溶液时会出现白色沉淀,则这种微粒的符号是______;
溶液时会出现白色沉淀,则这种微粒的符号是______;
(3)某原子失去一个电子形成该微粒,则这种微粒的符号是______;
(4)某原子得到两个电子形成该微粒,则这种微粒的符号是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com