
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2mol SO 2、1mol O 2 | 4mol SO 3 |
| n (SO 3)/mol | 1.6 | a |
| 反应物的转化率 | α 1 | α 2 |
| A. | α 1+α 2>1 | |
| B. | 1.6<a<3.2 | |
| C. | 若甲中反应2 min时达到平衡,则2 min 内平均速率 ν (O 2)=“0.2“molL -1min -1 | |
| D. | 甲平衡后再加入0.2 mol SO 2、0.2 mol O 2和0.4 mol SO 3,平衡逆向移动 |
分析 A.因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,三氧化硫的转化率会减小;
B.乙中2molSO3与甲建立的平衡互为等效平衡,由于体积相同,乙的物质的量变为2倍,则a大于甲中的2倍;
C.计算二氧化硫的反应速率,利用反应速率之比等于化学计量数之比计算氧气的反应速率;
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,压强增大,平衡正向移动.
解答 解:A.因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,减小三氧化硫的转化率,则α1+α2<1,故A错误;
B.乙中2molSO3与甲建立的平衡完全相同,体积相同,乙的物质的量变为2倍,则a大于甲中的2倍,则a>3.2,故B错误;
C.ν(SO2)=$\frac{\frac{0.16mol}{2L}}{2min}$=0.4mol•L-1•min-1,由反应速率之比等于化学计量数之比,则ν(O2)=0.2 mol•L-1•min-1,故C正确;
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,压强增大,该反应为气体体积缩小的反应,则平衡正向移动,故D错误;
故选C.
点评 本题考查化学平衡的计算,明确甲、乙中物质的量的关系及体积不变是解答本题的关键,题目难度中等,选项AB为解答的难点.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
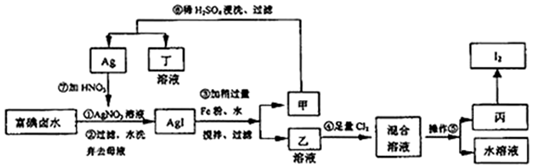
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
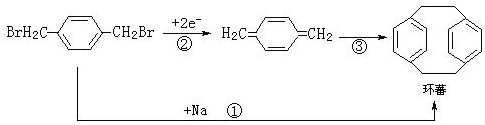
| A. | 反应①属于水解反应 | |
| B. | 反应③属于加成反应 | |
| C. | 环蕃所有的碳原子一定在同一个平面上 | |
| D. | 环蕃的核磁共振氢谱有3组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷的二氯代物和丙烷的一氯代物 | |
| B. | 正丁烷的一氯代物和异戊烷的一氯代物 | |
| C. | 新戊烷的一氯代物和C(CH2CH3)4的一氯代物 | |
| D. | C2H6的五氯代物和C5H8属于炔烃的同分异构体数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡 所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol•L-1•s-1 | |
| D. | 容器Ⅲ中平衡后,等温条件下充入一定量He,平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  比较 Cl2、Fe3+、I2的氧化性 | B. |  制取 Fe(OH)2 制取 Fe(OH)2 | ||
| C. | 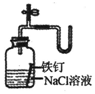 证明铁生锈时空气参加反应 | D. | 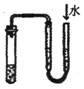 检查装置气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、NO3-、Cl- | B. | K+、Na+、HCO3-、Cl- | ||
| C. | Na+、CO32-、SO42-、NO3- | D. | Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 通过膜电池可除去废水中的乙酸钠和对氯笨酚(
通过膜电池可除去废水中的乙酸钠和对氯笨酚( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | B为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为 +e-═Cl-+ +e-═Cl-+ | |
| D. | 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com