
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
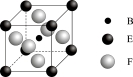
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上学期期中考试化学试卷(解析版) 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O),已知氯化铜易溶于水,难溶于乙醇。

(1)溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验出溶液1中Fe2+的试剂是 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
(2)试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的(填序号) 。
A.NaOH
B.NH3·H2O
C.CuO
D.Cu2(OH) 2CO3
E.CuSO4
调节pH至4~5的原因是 。
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、 。
(4)得到CuCl2·xH2O晶体最好采用的干燥方式是 。
A.空气中加热蒸干
B.空气中低温蒸干
C.HCl气流中加热烘干
D.HCl气流中低温烘干
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。根据实验数据测得x= (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
A.缩小容器容积
B.及时分离出Y、Z
C.使用合理的催化剂
D.升高体系温度
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
B.标况下,22.4L氯气通入足量氢氧化钠溶液中充分反应,转移的电子数为NA
C.18g D2O和18g H2O中含有的质子数均为10NA
D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
查看答案和解析>>
科目:高中化学 来源:2016届山西省晋中市四校高三上学期期中联考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。
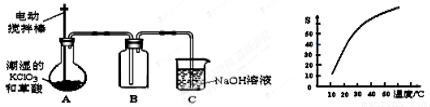
(1)B必须放在冰水浴中控制温度,其原因是 。
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
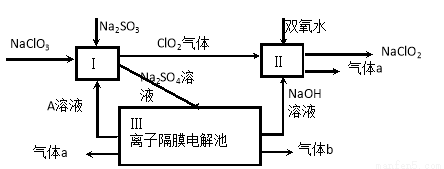
① Ⅱ中反应的离子方程式是 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式 。
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量 。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源:2016届新疆兵团农二师华山中学高三上学期第二次月考化学试卷(解析版) 题型:选择题
全部属于纯净物的是
A.福尔马林、白酒、食醋
B.汽油、油脂、酚醛树脂
C.石炭酸、盐酸、冰醋酸
D.甘油、乙醇钠、氯仿
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中测试化学试卷(解析版) 题型:填空题
A是实验室中常见的有机物,它易溶于水,具有特殊香味,并能进行如下图所示的多种反应。已知C中所含碳原子数是A中的2倍。

(1)A的分子式为________,官能团 。
(2)写出下列反应的化学方程式。
反应①:___________________________;
反应②:___________________________;
反应④:___________________________。
(3)比较反应①与钠和水反应的现象的相同点和不同点。
相同点:___________________________________;
不同点:___________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届北京市海淀区高三上学期期中测试化学试卷(解析版) 题型:选择题
下列关于硅及其化合物的说法不正确的是
A.单质硅常用作半导体材料
B.硅酸钠是制备木材防火剂的原料
C.二氧化硅是制备光导纤维的基本原料
D.硅酸可由二氧化硅与水直接反应制得
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
下列各组溶液中,c(Cl-) 最大的是
A.500 mL 1 mol/L KCl B.800 mL 0.5 mol/L MgCl2
C.250 mL 1 mol/L FeCl3 D.200 mL 1 mol/L CaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com