
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。下列说法不正确的是
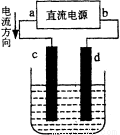
A.a为正极、b为负极
B.c为阳极、d为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:填空题
(8分)肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。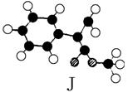
试回答下列问题。
肉桂酸甲酯的结构简式为 。(2)分子中的官能团的名称为 。
(3)在苯环上的一氯代物有 种。
(4)写出该肉桂酸甲酯在氢氧化钠溶液中水解的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:选择题
下列有关实验的说法不正确的是
A.纸层析法进行Cu2+和Fe3+混合液分离时,Fe3+在固定相中分配比例较低
B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量
C.在铝与过量3mol·L-1硫酸溶液反应的试管中加入少量NaCl固体,反应速率会加快
D.吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列关于Na、Mg及其化合物的说法正确的是
A.钠在空气中燃烧生成Na2O
B.点燃的镁条在CO2中燃烧,生成氧化镁和碳
C.钠保存在酒精中是因为酒精不与钠发生反应,且酒精的密度比钠小
D.足量稀HCl加入Mg(OH)2沉淀中,加热蒸干得无水MgCl2固体
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
分析下图的能量变化示意图,下列选项正确的是
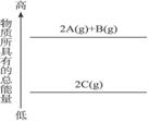
A.2C====2A+B;ΔH>0
B.2A+B====2C;ΔH>0
C. 2C(g)==== 2A(g)+B(g);ΔH<0
D. 2A(g)+B(g)====2C(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列电离方程式,不正确的是
A.KOH==K++OH- B. CH3COOH==CH3COO- + H+
C. NH3·H2O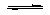 NH4++OH- D. Na2CO3 == 2Na++CO32-
NH4++OH- D. Na2CO3 == 2Na++CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:推断题
(12分)化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成,途径如下图所示:
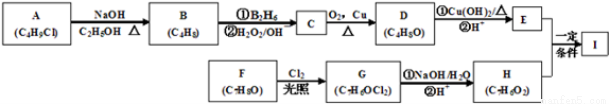
已知以下信息:
① A的核磁共振氢谱表明其只有一种化学环境的氢;
②
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基 。
。
回答下列问题:
(1)A的结构简式为 ;
(2)指出下列反应类型A→B ,F→G ;
(3)D新制Cu(OH)2反应的化学方程式为 ;
(4)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件,共有 种(不考虑立体异构)。写出任意两种的结构简式 、 。
①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2;
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
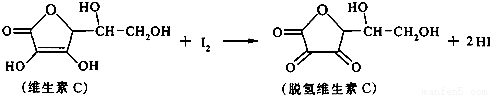
下列说法正确的是 ( )
A.滴定时可用淀粉溶液作指示剂 B.上述反应为取代反应
C.滴定时应剧烈振荡锥形瓶 D.脱氢维生素C的分子式为C6H5O6
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省杭州市高二年级教学质量检测模拟卷化学试卷(解析版) 题型:填空题
(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。

(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
时间(h) 物质的量(mol) |
| 0 | 1 | 2 | 3 | 4 |
N2 |
| 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 |
| 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 |
| 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为 mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2  2NH3 的化学平衡常数K = (保留两位小数)。
2NH3 的化学平衡常数K = (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com