
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
分析 H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,据此讨论,若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余;若n(H2S):n(O2)=2:1,发生反应①,没有气体;若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,气体为氧气、二氧化硫;若n(H2S):n(O2)=2:3,发生反应②,气体为二氧化硫;若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,据此进行分析.
解答 解:H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,
若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余,则:
2 H2S+O2═2 S↓+2 H2O 体积变化△V;
2 1 3
50ml 25ml 100mL-25mL=75mL
剩余气体为25mLH2S,原混合气体中O2为25mL,H2S为100mL-25mL=75mL,符合题意;
若n(H2S):n(O2)=2:1,发生反应①,没有剩余气体,不符合题意;
若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,则:
2 H2S+3 O2═2 SO2+2H2O 体积变化△V;
2 3 2 3
50mL 75mL 50mL 100mL-25mL=75mL
剩余气体为氧气、二氧化硫,其中二氧化硫为50mL,不符合题意;
若n(H2S):n(O2)=2:3,发生反应②,最后气体为二氧化硫,体积为50mL,不符合题意;
若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,则:
2 H2S+3 O2═2 SO2+2H2O
25mL 37.5mL 25mL
发生反应①的气体体积为:100mL-25mL-37.5mL=37.5mL,其中消耗硫化氢的体积为:37.5mL×$\frac{2}{3}$=25mL,反应消耗氧气的体积为:37.5mL×$\frac{1}{3}$=12.5mL,
原混合气体中硫化氢的总体积为:25mL+25mL=50mL,氧气的总体积为:37.5mL+12.5mL=50mL,
故剩余气体为H2S,原混合气体中可能含有O225mL、H2S75mL;剩余气体为25ml二氧化硫,则H2S为50mL氧气、50mL硫化氢,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意讨论法、差量法在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
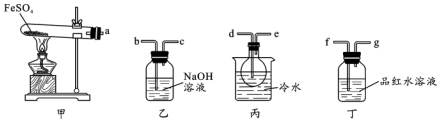
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
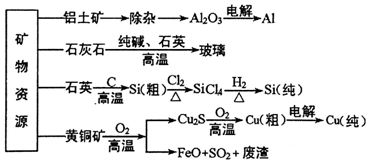
| A. | 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 | |
| B. | 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 | |
| C. | 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1 | |
| D. | 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
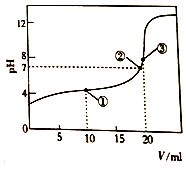 298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )
298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | HR溶液中只含有一种分子和三种离子 | |
| B. | 在①②③点对于的溶液中,②点水的电离程度最大 | |
| C. | ③点对应的溶液中有c(R-)>c(Na+)>c(H+)>c(OH-) | |
| D. | ①点对应的溶液中R-的水解程度小于HR的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(CH3COOH) | B. | c(CH3COOH)>c(Na+)>c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(CH3COOH) | D. | c(CH3COO-)>c(CH3COOH)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
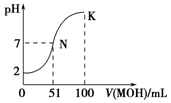 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com