
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3����������ǿ�������������ʵ�飺
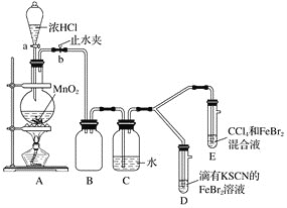
(1)��װ��A�з�����Ӧ�����ӷ���ʽ��____________________��
������ʵ��װ�ô���һ�����ԵIJ��㣬��ָ��__________________��
(2)�ø������װ�ý���ʵ�飬ʵ��������£�_______��
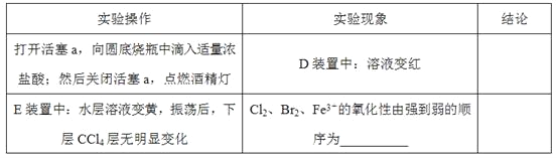
(3)��æ�ڹ۲�ͼ�¼��û�м�ʱֹͣ��Ӧ��D��E�о��������µı仯��Dװ���У���ɫ������ȥ��Eװ���У�CCl4��������ɫ��Ϊ��ɫ������ɫ���ֱ����ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
i.Fe3+3SCN-![]() Fe(SCN)3��һ�����淴Ӧ��
Fe(SCN)3��һ�����淴Ӧ��
ii.(SCN)2������±�ص������ơ������ԣ�Cl2��(SCN)2��
iii.Cl2��Br2��Ӧ����BrCl��BrCl�ʺ�ɫ(�Դ���ɫ)���е�Լ5�棬����ˮ�ܷ���ˮ�ⷴӦ���Ҹ÷�ӦΪ��������ԭ��Ӧ��
iv.AgClO��AgBrO��������ˮ��
����ƽ���ƶ�ԭ��(�����������)����Cl2����ʱD����Һ��ɫ��ȥ��ԭ��_______������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�___________��Һ������Һ��ɫ________�������������Ǻ����ġ�
��̽��E����ɫ�仯��ԭ�����ʵ�����£�
�÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ��������������������������������ʽ(���ӻ�ѧ����ʽ����)���ͽ�������ɫ������ԭ��__________________��
���𰸡�MnO2��4H����2Cl��![]() Mn2����Cl2����2H2O ȱ��β������װ�� Cl2�� Br2�� Fe3�� ����������SCN����Ӧ2SCN����Cl2===2Cl����(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3����3SCN��
Mn2����Cl2����2H2O ȱ��β������װ�� Cl2�� Br2�� Fe3�� ����������SCN����Ӧ2SCN����Cl2===2Cl����(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3����3SCN��![]() Fe(SCN)3ƽ�������ƶ�����ɫ KSCN ���ɫ BrCl��H2O===HBrO��HCl��Ag����Cl��===AgCl��
Fe(SCN)3ƽ�������ƶ�����ɫ KSCN ���ɫ BrCl��H2O===HBrO��HCl��Ag����Cl��===AgCl��
��������
��1����A��Ũ������������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ��
�������ж�����ֱ���ſգ�Ҫ�ü�Һ����β����
��2������a����Բ����ƿ�е�������Ũ���ᣬȻ��رջ���a����ȼ�ƾ��Ƽ��ȣ��������ӵĻ�ԭ�Ա�������ǿ���������������������ӣ������������ӣ�
��3���ٹ���������SCN-��Ӧ��SCN-Ũ�ȼ�С�����������Ӻ���������ӷ�Ӧƽ��ԭ��������
����Һ�м����Ȼ��������軯����Һ������Һ��ɫ�仯�жϣ�
���Ȼ����ܷ���ˮ�ⷴӦ�����ᣬ����AgBrO��AgCl���ܽ��Է�����
��1����Ũ������������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ�����ӷ���ʽΪMnO2��4H����2Cl��![]() Mn2����Cl2����2H2O��
Mn2����Cl2����2H2O��
�����������ж���ֱ���ŷŵ������л���Ⱦ������Ҫ�ü�Һ����β�������ʵ��װ�ô���һ�����ԵIJ���Ϊʵ��װ��ȱ��β������װ�ã�
��2������a����Բ����ƿ�е�������Ũ���ᣬȻ��رջ���a����ȼ�ƾ��Ƽ��ȣ��������ӵĻ�ԭ�Ա�������ǿ���������������������ӣ������������ӣ�����Dװ�������ȱ�죬Eװ����ˮ����Һ��ƣ����²�CCl4�������Ա仯��˵���Ժ��������ӣ�������δ�����������Cl2��Br2��Fe3+����������ǿ������˳��ΪCl2��Br2��Fe3����
��3���ٹ���������SCN-��Ӧ2SCN-+Cl2��2Cl-+(SCN)2��ʹSCN-Ũ�ȼ�С����ʹƽ��Fe3����3SCN��![]() Fe(SCN)3���淴Ӧ�����ƶ�����ɫ��Ϊ��������ɫԭ���鷽��Ϊ��ȡ������ɫ�����Һ���μ�KSCN��Һ������Һ���ɫ���������Ʋ��������ȡ������ɫ�����Һ���μ�FeCl3��Һ������Һ����죬�������Ʋ������
Fe(SCN)3���淴Ӧ�����ƶ�����ɫ��Ϊ��������ɫԭ���鷽��Ϊ��ȡ������ɫ�����Һ���μ�KSCN��Һ������Һ���ɫ���������Ʋ��������ȡ������ɫ�����Һ���μ�FeCl3��Һ������Һ����죬�������Ʋ������
�ڹ������������巴Ӧ�����Ȼ��壬�Ȼ��岻�ȶ�����ˮ��Ӧ��������ʹ����ᣬBrCl��H2O��HBrO��HCl�������Ӻ������ӷ�Ӧ���ɰ�ɫ�����Ȼ�����Ag����Cl����AgCl����������������ӷ�Ӧ���ɴ�������������ˮ���������ɵİ�ɫ����Ϊ�Ȼ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ʾ�ķ����о���������ˮ��Ӧ�����ʣ�����A���ô����������ŵ�С��Ľ����ƣ�

(1)�Ӵ������ȡ�µ�С����Ҫ����ֽ��һ������������Ŀ����_______________��
(2)�����ƿ������ҪԤ�������㹻���С�ף����������������ܳ��ֵIJ��������__________��������ʵ��տ�ʼ�ͽ������ɿ��ó�ˮ�棬A���ֳ��������� _______________________���������������ԭ����______________��
(3)��Ԥ�⣬����ˮ��Ӧ�����������������ƣ�
֤�������������Ƶ�ʵ�鷽������Ӧ��������______________________��
(4)��֪��Ӧ�������������ƾ���ʧ����д����ط�Ӧ�����ӷ���ʽ��______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ũҩ������Һ������ˮ����棬����ʯ��ˮ������ͭ��Һ��϶��ɵ�����Һ������������������ʢ�ţ�����Ϊ�����ũҩ�е�����ͭ��Ӧ���ڸ÷�Ӧ�У�����������������ǣ� ��
A. ��������ԭ��ӦB. ������������Ӧ
C. ���ǻ�ԭ��D. ��ʧȥ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������У��뾶���ɴ�С������˳����( )
�ٻ�̬X��ԭ�ӽṹʾ��ͼ��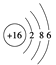 �ڻ�̬Y�ļ۵����Ų�ʽ��3s23p5
�ڻ�̬Y�ļ۵����Ų�ʽ��3s23p5
�ۻ�̬Z2���ĵ����Ų�ͼ��![]()
��W��̬ԭ����2���ܲ㣬����ʽ�� ![]()
A. ��>��>��>�� B. ��>��>��>�� C. ��>��>��>�� D. ��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ����Na+��Fe3+��Cl����SO42���������ӣ���֪Na+��Fe3+��Cl���ĸ�����Ϊ3��2��1������Һ��Fe3+��SO42���ĸ�����Ϊ
A. 1��2 B. 1��4 C. 3��4 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в����������ֽ���ǣ�������
A.NaHCO3
B.AgBr
C.AgCl
D.HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������۷������Ȼ�����Һ�У���ȫ��Ӧ����Һ�е�Fe3+��Fe2+Ũ����ȣ����ѷ�Ӧ��Fe3+��δ��Ӧ��Fe3+�����ʵ���֮���ǣ�������
A.2��3
B.3��2
C.1��2
D.1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�ͭ��(YBa2Cu3O7-x)����³�������(����Y��+3�ۣ�Cu��+2��+3��)����Y2(CO3)3��BaCO3��CuCO3����ڸ����·�Ӧ�Ƶá��ش��������⣺
(1)Y(��)��һ��ϡ������Ԫ�أ���Sc(��)ͬ�����ڡ�X��Ԫ�����ڱ��е�λ����_______��Ŀǰ�����ڱ��У����干��______��Ԫ�ء�
(2)��̬Cu3+�ĵ����Ų�ʽΪ________��ͭ��CuO��Cu2O������������߱�ǰ�����ȶ���ǿ��ԭ����____________________________________��
(3) CO32-��Cԭ���ȡ_______�ӻ�����һ�����ܣ�C_____O(����>������<��)��
(4)ij���Ʊ�ͭ��������x=0.2����n(Cu3+):n(Cu2+)=________��
(5)��ͼ����һ���Ʊ�ͭ���������ϵľ����ṹʾ��ͼ���仯ѧʽΪ______��������Y3+��������______������Ħ������ΪMg��mol-1�������ӏ�������ֵΪNA����þ�����ܶ�Ϊ____g��cm-3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A�����ˮ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壺Fe3+��3H2O![]() Fe(OH)3����3H+
Fe(OH)3����3H+
B����С�մ�����θ����ࣺHCO3����H��= CO2����H2O
C��ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2��2H+��2Cl��![]() Cl2����Mn2+��H2O
Cl2����Mn2+��H2O
D����FeCl3��Һ��ʴӡˢ��·�壺Fe3+��Cu = Fe2+��Cu2+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com