
| A. | Na、K、Rb | B. | N、P、As | C. | Si、P、Cl | D. | O、S、Cl |
科目:高中化学 来源: 题型:选择题
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+的结构示意图为: | |
| B. | 氯仿的化学式:CHCl3 | |
| C. | R2+离子核外有a个电子,b个中子,R原子表示为a+ba+b+2R | |
| D. | 溴化氢分子的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

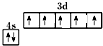 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成它的小分子结构简式为CH2=CHCOOR(R为烃基) | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 没有固定的熔沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com