
分析 (1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890,.3kJ•mol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量;
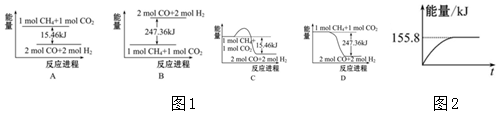
(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量,反应为放热反应,据此分析图象判断;
②依据①计算得到的反应的焓变,图中中是反应达到平衡状态时放热155.8KJ,计算反应的甲烷得到转化率;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
反应C(石墨,s)+2H2(g)=CH4(g)可以是②+③-①得到,由此分析解答;
(4)A.CO2与H2O反应生成CH4和O2,为吸热反应;
B.将固态碳合成C60,以C60作燃料,产物相同;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性;
解答 解:(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890,.3kJ•mol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量等于890,.3kJ•mol-1,
故答案为:=;
(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量=15.46KJ×16=247.36KJ,反应焓变△H=-247.36KJ/mol,反应为放热反应,反应物能量高于生成物,反应的热化学方程式为:CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-247.36KJ/mol,符合能量变化的图象只有D符合,
故答案为:D;
②反应的热化学方程式为:CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-247.36KJ/mol,图象可知反应达到平衡状态放出热量155.80KJ,则反应的甲烷物质的量=$\frac{155.80KJ}{247.36KJ/mol}$=0.63mol,甲烷转化率为63%,
故答案为:63%;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
盖斯定律计算,②+③-①得到,反应C(石墨,s)+2H2(g)=CH4(g)△H=-74.8 kJ•mol-1,
故答案为:-74.8 kJ•mol-1;
(4)A.甲烷与氧气的反应为放热反应,可知CO2与H2O反应生成CH4和O2为吸热反应,故A错误;
B.将固态碳合成C60,以C60作燃料,产物相同,研究方向不可行,故B错误;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性,利用优质催化剂、太阳能实现转化,故C正确;
故选C.
故答案为:C;
点评 本题考查了热化学方程式书写、盖斯定律计算、反应热与能源,为高频考点,把握物质的性质、反应中的能量变化、化学研究等为解答的关键,侧重分析与应用能力的考查,注意化学研究方案的可行性分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、OH-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、Cl-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质原因是具有丁达尔效应 | |
| B. | 静电除尘除去空气中的飘尘是利用了胶体粒子的带电性 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3是氧化产物 | B. | 每生成1molCO2,转移2mol电子 | ||
| C. | Cl2是氧化剂 | D. | C发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充电时,电解质溶液中K+向阳极移动 | |
| C. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在沸水中滴入含0.1molFeC13的饱和溶液,制得胶粒数为0.1 NA | |
| B. | 含0.4mol HNO3的稀硝酸与足量Fe反应,转移电子数为1.2 NA | |
| C. | 120 gNaHSO4和MgSO4的晶体混合物中阳离子数为NA | |
| D. | 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com