
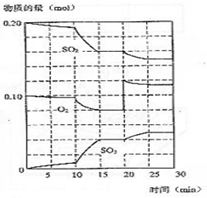
 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0分析 (1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(2)降低温度平衡向放热反应方向移动,根据平衡的移动判断温度对平衡常数、二氧化硫转化率影响,降低温度反应速率减小;
(3)反应混合物各物质的物质的量不随时间变化,说明反应处于平衡状态;
(4)由图可知,反应进行至20min时,改变体积,平衡向正反应移动,瞬间只有氧气的浓度增大;由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
解答 解:(1)2SO2(g)+O2 (g)?2SO3(g),该反应的平衡常数表达式K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}[{O}_{2}]}$,
故答案为:$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}[{O}_{2}]}$;
(2)该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数k增大,二氧化硫转化率增大,降低温度反应速率减小,
故答案为:增大;增大;减小;
(3)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25-30min;
(4)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;由图可知,反应向正反应进行未达到平衡状态,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;
故答案为:增大氧气的浓度;ab.
点评 本题考查平衡常数、平衡移动、平衡影响元素、化学平衡图象等,难度中等,图象问题解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少.(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律,难度中等.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、SCN-、Cl- | B. | Na+、K+、NO3-、Ba2+ | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Fe2+、Ag+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合价升降总数不等 | B. | 这两个反应的类型不相同 | ||
| C. | 产物种类相同 | D. | 硫元素价态变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
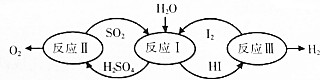
| A. | 反应Ⅰ中SO2是还原剂 | B. | 反应Ⅲ中H2是还原产物 | ||
| C. | 氧化性强弱顺序:H2SO4>I2>SO2 | D. | 该转化关系可实现分解H2O制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:HCl>H2 S>PH3 | ||
| C. | 酸性强弱:HClO4>H2 SO4>H3PO4 | D. | 熔点:Na>SiO2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| B. | 乙烯的结构简式可表示为CH2CH2 | |
| C. | 苯、乙醇和乙酸都可以发生取代反应 | |
| D. | 油脂皂化反应基本完成的现象是反应后静置,反应液分两层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com