
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;
(2)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
再根据平衡常数K=1列方程计算解答;
(3)由表中数据可知,温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应.若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则平衡正向移动;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡
解答 解:(1)CO2(g)+H2(g)?CO(g)+H2O(g)平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(2)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
则$\frac{y×y}{(2-y)×(1-y)}$=1,解得y=$\frac{2}{3}$,故CO2气体的转化率为$\frac{\frac{2}{3}mol}{2mol}$×100%=33.3%,
故答案为:33.3%;
(3)由表中数据可知,温度升高,平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应.若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO2的浓度增大,则平衡逆向移动,放出热量,故容器内气体温度升高;
故答案为:升高;
(4)A.混合气体中c(CO)不变,说明到达平衡,故A正确;
B.由于反应前后气体体积不变,容器内压强始终不变,不能说明到达平衡,故B错误;
C.单位时间内生成n mol CO的同时,生成n mol的H2O,都体现正反应的方向,未体现正与逆的关系,不能说明到达平衡,故C错误;
D.υ(正、CO)=υ(逆、CO2),说明CO的生成速率与消耗速率相等,说明到达平衡,故D正确;
故选:AD.
点评 本题考查化学平衡常数的应用、化学平衡移动,平衡状态判断等,难度中等,掌握化学平衡常数的书写与应用,比较容易.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
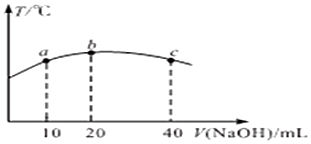
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
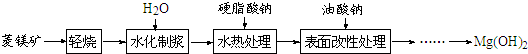

| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
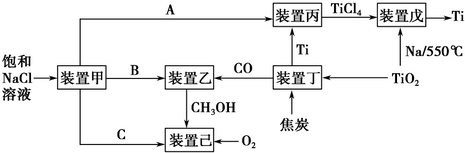
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一种气体通入品红溶液,溶液褪色,说明该气体一定是二氧化硫 | |
| B. | K+、NH4+、SO42-、CO32-离子组在加入铝粉能放出大量H2的溶液中一能能大量共存 | |
| C. | FeBr2溶液中通入过量Cl2时的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 在纯碱溶液中逐滴加入稀盐酸时,开始没有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com