
 己二酸
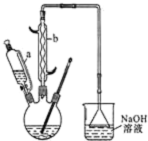
己二酸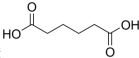 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
分析 (1)滴液漏斗的细支管a能使三颈瓶中的气体通过a进入滴液漏斗上方,从而使溶液顺利滴下;仪器b的名称为:球形冷凝管(或冷凝管);
(2)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,据此写反应的化学方程式;
(3)该反应放热,反应温度高,易导致溶液暴沸,甚至可能引起爆炸;二氧化氮有毒,能污染空气;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯;
(5)粗产品依据溶解度差别,可以通过重结晶提纯;反应的环己醇为5.4mL,质量=5.4ml×0.962g/ml=5.1948g,结合化学方程式计算理论上生成己二酸的质量,进而计算产量.
解答 解:(1)滴液漏斗的细支管a能使三颈瓶中的气体通过a进入滴液漏斗上方,通过滴液漏斗上下方气体压强差而使溶液顺利滴下;仪器b的名称为:球形冷凝管,
故答案为:平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下;球形冷凝管(或冷凝管);
(2)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,反应的化学方程式为Na2CO3+2NO2═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2,
故答案为:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2;
(3)三口烧瓶中滴加环己醇时,反应温度迅速上升,说明该反应为放热反应,需控制好环己醇的滴入速率,如果环己醇的滴入速率过快,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;二氧化氮有毒,不能直接排空,如果产生的二氧化氮气体来不及被碱液吸收而外逸到空气中而污染空气,
故答案为:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的NO2气体来不及被碱液吸收而外逸到空气中;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失,
故答案为:苯;
(5)粗产品再溶解,再结晶析出,通过重结晶的方法提纯己二酸,
反应的环己醇为5.4mL,质量=5.4ml×0.962g/ml=5.1948g,设生成己二酸的质量为m,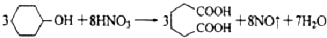
3×100 3×146
5.1948g m
3×100:3×146=5.1948g:m
m=$\frac{3×146×5.1948g}{3×100}$=7.58g
己二酸产率=$\frac{5.7g}{7.58g}$×100%=75%,
故答案为:重结晶;75%.
点评 本题考查物质制备,为高频考点,涉及物质的分离与提纯、对操作的分析评价、化学方程式的计算等,侧重实验分析能力及知识综合应用能力的考查,综合性较强,难度中等.


科目:高中化学 来源: 题型:选择题
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2016 年8月20日 |
| A. | 富含蛋白质的是鸡蛋 | |
| B. | 富含维生素的是脱水青菜和橙汁 | |
| C. | 富含糖类的物质只有白砂糖 | |
| D. | 富含油脂的是精炼食用植物油和奶油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.
乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
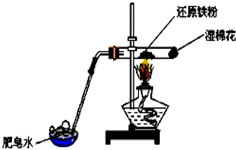
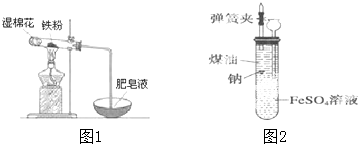
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
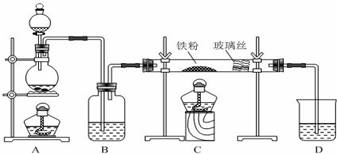
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
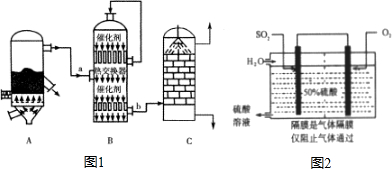 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
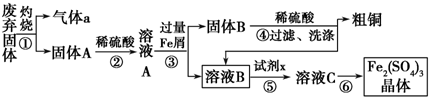
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com