
| ��� | ��ѧ��Ӧ | ���ӷ���ʽ | ���� |
| A | Cu��AgNO3��Һ��Ӧ | Cu+Ag+�TCu2++Ag | ��ȷ |
| B | ��������NaOH��Һ��Ӧ | 2Al3++3O2-+2OH-�T2AlO2-+H2O | ����Al2O3��Ӧд��������ʽ |
| C | Fe��ϡ���ᷴӦ | 2Fe+6H+�T2Fe3++3H2�� | ��ȷ |
| D | ��������ͭ��Һ��Ӧ | 2Na+Cu2+�TCu+2Na+ | ����CuSO4��Ӧд��������ʽ |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A����ɲ��غ㣻
B��������Ӧ������ѧʽ��
C�������Ϸ�Ӧ����ʵ��
D�������Ϸ�Ӧ����ʵ��
��� �⣺A��Cu��AgNO3��Һ��Ӧ�����ӷ���ʽ��Cu+2Ag+�TCu2++2Ag�����۴���A����
B����������NaOH��Һ��Ӧ�����ӷ���ʽ��Al2O3+2OH-=2AlO2-+H2O��������ȷ����B��ȷ��
C��Fe��ϡ���ᷴӦ�����ӷ���ʽ��Fe+2H+�TFe2++H2�������۴���C����
D����������ͭ��Һ��Ӧ����������ͭ�������������ơ�ˮ���ò���ͭ�����۴���D����
��ѡ��B��
���� ���⿼�������ӷ���ʽ�ͻ�ѧ����ʽ����д�����շ�Ӧԭ���ǽ����Ĺؼ���ע�����ӷ�Ӧ��ѭ����ʵ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
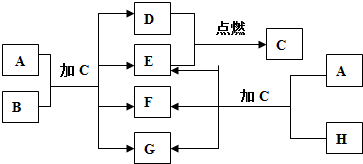
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
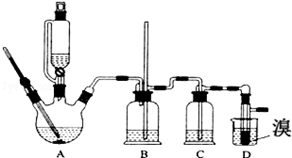
| �Ҵ� | 1��2-�������� | ���� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
| �ܶ�/g•cm-3 | 0.79 | 2.2 | 0.71 |
| �е�/�� | 78.5 | 132 | 34.6 |
| �۵�/�� | һl30 | 9 | -1l6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽�� | �������� | ʵ������ | ���ۻ���� |
| 1 | �۲���ˮ����ɫ | ����Cl2 | |
| 2 | ����ɫ������� | ����H+ | |
| 3 | ȡ������ˮ���Թ��У�����ϡ�����ữ����������Һ | �а�ɫ�������� | |
| 4 | ȡ������ˮ���Թ��У������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | c��NH4+����c��Cl-����c��OH-����c�� H+�� | B�� | c��Cl-����c��NH4+����c�� H+����c��OH-�� | ||
| C�� | c��NH4+��+c�� NH3��=c��Cl-��+c��OH-�� | D�� | c��NH4+��+c�� NH3•H2O��+c�� NH3��=c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
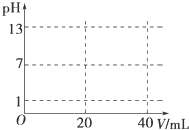 ��Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮
��Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

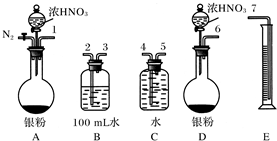
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com