
| ��� | �� | �� |
| PH | 12 | 12 |
| ��Һ | ��ˮ | ����������Һ |
| A�� | ��AlCl3��Һ������Ӧ�����ӷ���ʽ��ΪAl3++3OH-�TAl��OH��3�� | |
| B�� | ����Һ�����ʵ���Ũ��Ϊ0.01mol•L-1 | |
| C�� | �٢�����Һ�ֱ��ˮϡ��10����ϡ�ͺ���Һ��pH���٣��� | |
| D�� | ������Ģ٢�����Һ�ֱ���0.01mol•L-1��������ȫ�кͣ����������������٣��� |
���� A��һˮ�ϰ�Ϊ������ʣ�������ѧʽ����������Ϊǿ����ʣ���ȫ���룻
B��һˮ�ϰ�Ϊ������ֵ��룻
C��������ʣ�ϡ��ʱ����̶�����
D��һˮ�ϰ����������ƶ���һԪ��к�����������ͬ��
��� �⣺A����ˮ���Ȼ�����Ӧ���ӷ���ʽ��Al3++3NH3•H2O=Al��OH��3��+3NH4+�������������Ȼ�����Ӧ���ӷ���ʽ��Al3++3OH-�TAl��OH��3������A����
B��pHΪ12��һˮ�ϰ�������������Ϊ0.01mol/L����Ϊһˮ�ϰ�Ϊ������ֵ��룬����һˮ�ϰ���Ũ��ԶԶ����1mol/L����B����
C��pH=12��һˮ�ϰ�ϡ���������в���һˮ�ϰ����룬ϡ��10��pH����11С��12����pH=2������������Һ������������ȫ���룬ϡ��10����pH����11����C��ȷ��
D��һˮ�ϰ����������ƶ���һԪ��к�����������ͬ�����Ե�����Ģ٢�����Һ�ֱ���0.01mol•L-1��������ȫ�кͣ�����������������=�ڣ���D����
��ѡ��C��
���� ���⿼����������ʵ��롢���ӷ���ʽ��д����Һϡ��pHֵ�仯���ɣ���Ϥ������ʵ����ص㼰����ƽ���ƶ���Ӱ�������ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ֻ�Т� | B�� | ֻ�Т٢� | C�� | ֻ�Тڢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��3 | B�� | 9��8 | C�� | 3��4 | D�� | 4��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
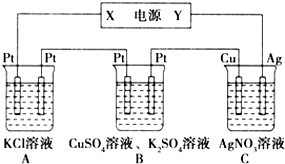 ��ͼ��ʾ��װ���У���ͨ��ֱ����5minʱ��ͭ�缫��������2.16g���Իش�
��ͼ��ʾ��װ���У���ͨ��ֱ����5minʱ��ͭ�缫��������2.16g���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢݢ� | B�� | �٢ۢ� | C�� | �ۢ�� | D�� | �ۢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Ȼ�ѧ����ʽ | ƽ�ⳣ�� | |
| 500�� | 700�� | |
| ��2H2��g��+CO��g��?CH3OH��g����H1=a kJ•mol-1 | ��2.5 | 0.2�� |
| ��H2��g��+CO2��g��?H2O��g��+CO��g����H2=b kJ•mol-1 | ��1.0 | ��2.3 |
| ��3H2��g��+CO2 ��g��?CH3OH��g��+H2O��g����H3=c kJ•mol-1 | ��K3 | 4.6 |
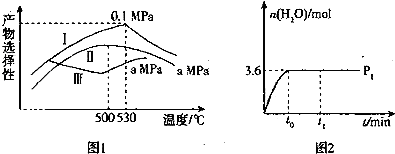
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
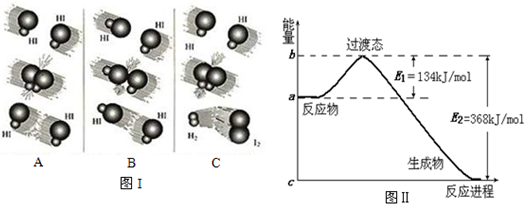
| ��ѧ�� | C-H | Cl-Cl | C-Cl | H-Cl |
| ����/kJ•mol-1 | X | 243 | 330 | 432 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com