
| 序号 | 检验方法 | 结论 |
| A | 一种未知溶液滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl- |
| B | 一种未知溶液滴加盐酸,有气泡产生 | 未知溶液中一定含有CO32- |
| C | 一种未知溶液滴加NaOH溶液,加热后产生能使湿润的红色石蕊试纸变蓝的气体 | 未知溶液中一定含有NH4+ |
| D | 一种未知溶液滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(NO)/mol | 1.000 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
| n(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
| n(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
| n(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 |
| 生成SO2的质量(g) | 生成SO3的质量(g) | |
| 3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
| 3g硫在纯氧中燃烧 | 5.82~5.88 | 0.15~0.225 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、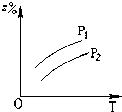 |
C、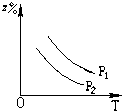 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(X) |
| c(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、112mL |
| B、1008mL |
| C、224mL |
| D、336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
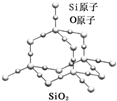
| A、晶体中Si、O原子个数比为1:2 |
| B、晶体中Si、O原子最外层都满足8电子结构 |
| C、晶体中一个硅原子含有Si-O键数目为4 |
| D、晶体中最小环上的原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸雨 | B、臭氧空洞 |
| C、光化学烟雾 | D、温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电过程中镉元素被氧化 |
| B、充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| C、放电时负极附近溶液的碱性不变 |
| D、放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com