
【题目】A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB2-离子的空间构型为__________。A、B、C 3种元素第一电离能由大到小的顺序为__________________ 。(用相应的元素符号表示)
(2)元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是_________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是___________。
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为___________。

(5)向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的核外电子排布式为_________________。
②1 mol该配合物中含配位键的数目为___________。
【答案】 V形 N > O > Si 两种化合物均为原子晶体,Si—O键键能大于Si—N键 sp3 CrO2 [ Ar ] 3d3 6NA
【解析】元素A原子最外层电子数比内层多3个,内层电子数为2,最外层电子数为5,则A为N元素,元素C的最高价和最低价代数和等于0,为第ⅣA族,由于原子序数依次增大,则C为Si元素,元素B基态原子核外有2个未成对电子,且原子序数大于N元素小于Si元素,则价电子排布只能为2s22p4,所以B为O元素,元素D位于周期表ⅥB族,属于前四周期元素,则D为Cr元素,综上所述,A、B、C、D四种元素依次为:N、O、Si、Cr。
(1). NO2中氮原子的价电子对数=2+ ![]() =2+1=3,杂化类型为sp2,原子轨道构型为平面三角形,有一对孤对电子占据一条杂化轨道,则N与两个O形成V形,则NO2离子的空间构型为V形;同一周期中,元素的第一电离能随原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,则第一电离能N>O>C,同一主族从上到下元素的第一电离能逐渐减小,则第一电离能C>Si,所以N、O、Si三种元素的第一电离能由大到小的顺序为:N > O > Si,故答案为:V形;N > O > Si;
=2+1=3,杂化类型为sp2,原子轨道构型为平面三角形,有一对孤对电子占据一条杂化轨道,则N与两个O形成V形,则NO2离子的空间构型为V形;同一周期中,元素的第一电离能随原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,则第一电离能N>O>C,同一主族从上到下元素的第一电离能逐渐减小,则第一电离能C>Si,所以N、O、Si三种元素的第一电离能由大到小的顺序为:N > O > Si,故答案为:V形;N > O > Si;
(2). N、O分别与Si形成的化合物均为原子晶体,由于氮原子半径大于氧原子半径且Si—O键键能大于Si—N键,所以O、Si形成的化合物熔点较高,故答案为:两种化合物均为原子晶体,Si—O键键能大于Si—N键;
(3). 在N2H4分子中,每个氮原子除了形成3个σ键外还有1个孤电子对,所以氮原子轨道的杂化类型为sp3,故答案为:sp3;
(4). 据图可知,在该晶胞中,O原子位于体心和面心,原子数4×![]() +2=4,Cr位于顶点和体心,数目为:8×
+2=4,Cr位于顶点和体心,数目为:8×![]() +1=2,Cr与O原子数目之比为1:2,则化学式为CrO2,故答案为:CrO2;
+1=2,Cr与O原子数目之比为1:2,则化学式为CrO2,故答案为:CrO2;
(5). ①. Cr原子序数为24,价电子排布式为3d54s1,Cr原子失去最外层电子和次外层2个电子生成Cr3+,则Cr3+电子排布式为[ Ar ] 3d3,故答案为:[ Ar ] 3d3;
②. 1mol该配合物中含有3molNH3,1molH2O和2molCl,配位数为6,则1 mol该配合物中含配位键的数目为6NA,故答案为:6NA。


科目:高中化学 来源: 题型:
【题目】对于某些离子或物质的检验所用试剂或方法不正确的是
A. 某溶液中加入盐酸产生气体,则其中一定含有CO32-
B. 用焰色反应检验钠元素的存在
C. 用氢氧化钠溶液和湿润的红色石蕊试纸检验NH4+
D. 用盐酸和氯化钡溶液检验 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:Cu2+ + 2Br - ![]() Cu +Br2
Cu +Br2
B. 碳酸氢钠的水解反应:HCO![]() +H2O
+H2O![]() CO32- + H3O+
CO32- + H3O+
C. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3 - = BaCO3↓+NH3·H2O+H2O
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2Fe2O4:3ClO- +2Fe(OH)3 = 2Fe2O42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 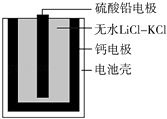
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu的质量为 ( )
A.0.64 g
B.1.28 g
C.2.56 g
D.5.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下四组实验:①号试管中豆浆+双缩脲试剂:②号试管中氨基酸溶液+双缩脲试剂:③号试管中淀粉+淀粉酶+双缩脲试剂;④号试管中煮沸后的淀粉酶+双缩脲试剂。四组实验中出现紫色的有
A. 四组B. 三组C. 两组D. 一组
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是
A.有了化学科学,人类能够更好利用能源和资源
B.化学科学将为环境问题的解决提供有力的保障
C.化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
D.化学家可以制造出自然界中不存在的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度 ( )
A. 等于9.2 mo1/L B. 小于 9.2 mo1/L
C. 大于 9.2 mo1/L D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+ , 进行如下实验操作时的合理顺序是 ( ) ①加足量氯水 ②加足量酸性高锰酸钾溶液 ③加足量硫氰化钾溶液
A.①③
B.②③
C.③①
D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com