
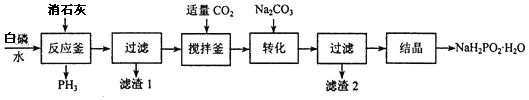
分析 白磷消石灰在反应釜中生成PH3和次磷酸二氢钙,过滤得到滤液通入适量二氧化碳除去过量的氢氧化钙,加入碳酸钠转化为次磷酸钠,结晶得到次磷酸钠晶体,
(1)根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比可得;
(2)过滤所得滤液呈碱性,通入二氧化碳中和过量的碱;
(3)加入碳酸钠,生成了碳酸钙沉淀,过滤后滤渣2碳酸钙;
(4)将滤液蒸发浓缩、冷却结晶、过滤可得到次氯酸钠粗晶体;
(5)反应釜中另一种生成物为次磷酸二氢钙,反应为:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2) 2+2PH3↑;
(6)碱性条件下,次磷酸根离子被氧化为HPO32-的反应方程式;与电镀相比,化学镀无需通电,化学镀对镀件的导电性无特殊要求.
解答 解:(1)反应4PH3(g)?P4(g)+6H2(g)的化学平衡常数K=$\frac{{c}^{6}({H}_{2})•c({P}_{4})}{{c}^{4}(P{H}_{3})}$;
故答案为:$\frac{{c}^{6}({H}_{2})•c({P}_{4})}{{c}^{4}(P{H}_{3})}$;
(2)由于过滤后所得滤液呈碱性,通入二氧化碳用于中和过量的碱(或调节溶液 pH 或除去部分 Ca2+离子);
故答案为:中和过量碱(或调节溶液 pH 或除去部分 Ca2+离子);
(3)上一步加入碳酸钠,生成了碳酸钙沉淀,过滤后滤渣2碳酸钙;
故答案为:CaCO3;
(4)将滤液蒸发浓缩、冷却结晶、过滤可得到次氯酸钠粗晶体;
故答案为:蒸发浓缩、冷却结晶、过滤;
(5)反应釜中另一种生成物为次磷酸二氢钙,白磷和氢氧化钙在水溶液中反应生成次磷酸二氢钙和PH3,反应的化学方程式为:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3↑;
故答案为:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2) 2+2PH3↑;
(6)在碱性条件下,次磷酸根离子被氧化为HPO32-,反应的离子方程式为:Cu2++H2PO2-+3OH-═Cu+HPO32-+2H2O;化学镀与电镀相比,优点为:化学镀无需通电,化学镀对镀件的导电性无特殊要求;
故答案为:Cu2++H2PO2-+3OH-=Cu+HPO32-+2H2O;化学镀无需通电或化学镀对镀件的导电性无特殊要求或其它合理答案.
点评 本题考查了物质制备的工艺流程,关键在于对工艺流程的理解,和知识的迁移运用,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼粗铜时,粗铜应作阴极 | |
| B. | 氯碱工业的阳极区得到的产品是H2和NaOH | |
| C. | 将金属与直流电源的负极相连的方法叫做外加电流的阴极保护法 | |
| D. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 熔点/℃ | 沸点/℃ | 水溶性 |
| -59.5 | 11.0 | 极易溶解 |
| A. | 化学方程式中的a=l,b=2 | |
| B. | 草酸起到还原剂的作用 | |
| C. | KC1O3中只有Cl元素被还原 | |
| D. | 在标准状况下生成5.6L C1O2,转移0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )| A. | Na2SO3溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | 当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-) | |
| C. | M 点时溶液中:c(SO32-)>c(HSO3-) | |
| D. | 向N点的吸收液中加水可使溶液的pH由6.2升高到7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
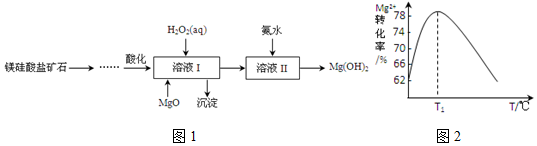
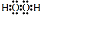 .溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
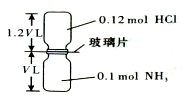 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡时,各容器的压强:②=①=③ | B. | 平衡时,I2的浓度:②>①=③ | ||
| C. | 平衡时,I2的体积分数:②=①=③ | D. | 从反应开始到达平衡的时间:①>②=③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳 | B. | 钠 | C. | 硫 | D. | 铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com