
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。
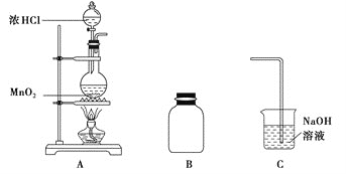
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
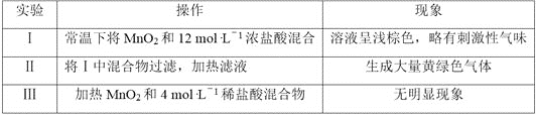
①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
【答案】还原性 HCl、H2O(g)  Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
【解析】
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,元素失电子化合价升高发生氧化反应,元素得电子化合价降低发生还原反应;
(2)MnO2与浓盐酸反应制取Cl2中混有氯化氢和水蒸气;
(3)氯气的密度比空气的密度大,采用向上排空气法收集氯气;
(4)C中氢氧化钠溶液用于吸收多余的Cl2,生成氯化钠、次氯酸钠和水;
(5)①复分解反应为两种化合物相互交换成分生成另外两种化合物;
②将Ⅰ中混合物过滤,加热滤液,Ⅱ中发生了分解反应,结合氧化还原反应单质守恒分析锰元素被还原的价态和物质;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将ⅰ、ⅱ做对比加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,氯元素化合价升高,锰元素的化合价降低,氯化氢做还原剂,利用氯化氢的还原性;
(2)用MnO2与浓盐酸在加入条件下反应制取Cl2,浓盐酸中的氯化氢易挥发,故Cl2含有杂质为HCl、H2O(g);
(3)氯气的密度比空气的密度大,采用向上排空气法,长导管进气,短导管出气,收集氯气的装置图为: ;
;
(4)C用于吸收多余的Cl2,防止污染环境,C中发生反应的离子方程式是:Cl2+2OH-![]() Cl-+ClO-+H2O;
Cl-+ClO-+H2O;
(5)①MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,酸碱中和反应生成盐和水,化学方程式是:MnO2+ 4HCl=MnCl4+2 H2O;
②Ⅱ中发生了分解反应,将Ⅰ中混合物过滤,加热滤液分解生成MnCl2和Cl2,反应的化学方程式是:MnCl4= MnCl2+Cl2↑;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验Ⅲ、Ⅳ作对比,得出的结论是Ⅲ中无明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度,才能被MnO2氧化,将ⅰ、ⅱ作对比,加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学根据课本第50页科学探究实验,用三支试管、水槽、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计了以下实验装置,完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
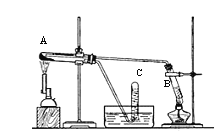
(1)写出该反应的化学方程式________。
(2)试管A中装的试剂是________ ;试管B中装的试剂是________。
(3)试管C中收集气体的方法叫作_________;收集的气体是(填化学式)_____。
(4)如果要在气体导出管口点燃该气体,则必须对该气体进行 _______。
(5)该同学欲确定反应后A试管中还原铁粉是否完全反应。设计了如下实验方案:第I步:待A试管冷却后,取少许其中的固体物质溶于稀硫酸,得溶液x;第II步:取少量溶液x滴加KSCN溶液,若溶液变红色则说明溶液x中含有_________。
①甲同学按照上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)____。
②乙同学按照上述实验方案进行了实验,结果溶液变红色。得出结论:A试管中还原铁粉反应完全。你觉得该结论是否合理?_______(填“合理”或“不合理”)请说明理由___________。(如果认为合理,此空不答。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下硫酸亚铁分解反应为2FeSO4![]() Fe2O3+SO2↑+SO3↑,下列说法不正确的是
Fe2O3+SO2↑+SO3↑,下列说法不正确的是
A.将产生的气体,通入紫色石蕊试液后溶液只变红不褪色
B.将反应后残留固体物质用盐酸溶解,再加入KMnO4溶液后褪色,说明硫酸亚铁固体分解完全
C.将少量产生的气体,分别通入含有NaOH的BaCl2溶液和含有氨水的BaCl2溶液中均产生白色沉淀,且沉淀成分相同
D.在实际实验操作过程将产生的气体通入品红溶液后溶液颜色先加深后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯、乙醛为原料,AlCl3 为催化剂制备 1,1–二苯乙烷,其反应原理为:
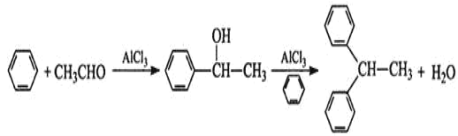
已知:AlCl3 固体遇水会发生较强烈水解。 I.制取装置如图所示。
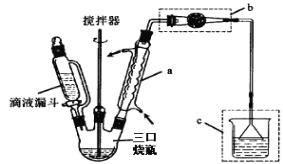
(1)该反应需控制反应温度为 20℃。控制 20℃的方法是________ ;该反应不高于 20℃ 的可能原因是:_______ 。
(2)仪器 a 的名称是 __________ 作用是 _________ ;装置 c 的作用是吸 收 HCl,写出产生 HCl 的化学方程式 ________;装置 b 的作用是 _____________ 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依 次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到 1, 1–二苯乙烷。
(3)分液漏斗中,产品在____(填“上”或“下”)层;洗涤操作中,第二次水洗的目的 是____;无水硫酸镁也可用物质 ______________ 代替。
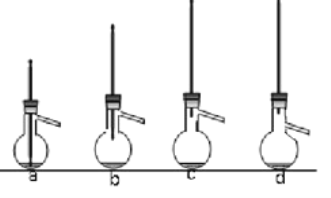
(4)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是______ (选填编号)。
(5)三口烧瓶中加入 120mL 苯(密度 0.88g/mL)、19g A1C13 和 3.7g 乙醛,20℃时充分反应, 制得纯净的 1,1–二苯乙烷 7.8g。该实验的产率约为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在标准状况下,11.2 L氖气含有NA个氖原子
B.1 mol -CH3中含有电子数为10NA
C.![]() mol的HCl分子所含分子数为
mol的HCl分子所含分子数为![]() NA
NA
D.标准状况下22.4 L H2中含中子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,已知Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
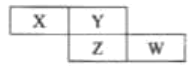
A.X、Y、Z和W均可以与氢元素形成18电子的共价化合物
B.简单离子半径:W<Z<Y<X
C.氧化物对应水化物的酸性:W>Z
D.Y与Z均为非金属,两者不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种酸性“二甲醚![]() 直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
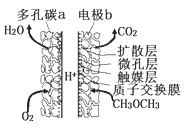
A.多孔碳a能增大气固接触面积,提高反应速率,该电极为正极
B.电极b上发生的反应为: ![]()
C.电子由b电极向a电极迁移
D.二甲醚(![]() )和乙醇(
)和乙醇(![]() )互为同分异构体关系
)互为同分异构体关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,如图为海水资源利用的部分过程。
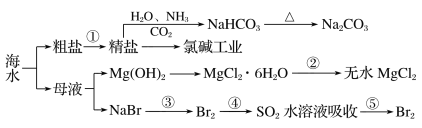
下列有关说法正确的是( )
A.用澄清石灰水可鉴别NaHCO3和Na2CO3
B.第③步和第⑤步均发生了氧化还原反应
C.在第③④⑤步中溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com