
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
| ||


科目:高中化学 来源: 题型:
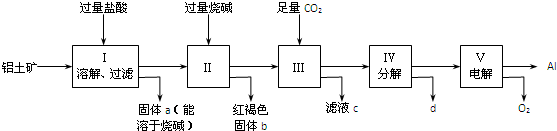
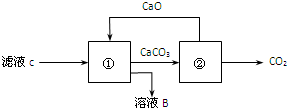
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 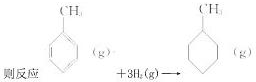 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
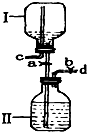 如图是某研究性小组设计的一个储气装置图.
如图是某研究性小组设计的一个储气装置图.查看答案和解析>>
科目:高中化学 来源: 题型:
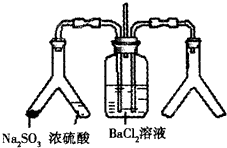 将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )| A、石灰石和稀硝酸 |
| B、CaO和氯化铵 |
| C、Cu和浓硝酸 |
| D、Na2O2和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
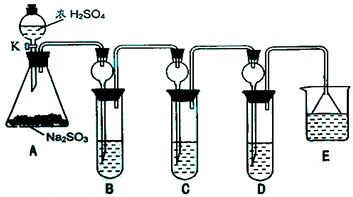 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤、洗涤干净备用. | / |
| 用另一干净试管取少量沉淀样品,加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
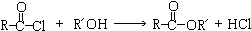
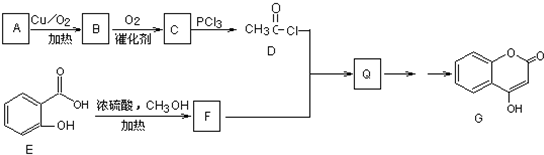
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c( OH-) |
| B、c(Na+)=c(H2SO3)+c(HSO3-)+c( H+) |
| C、c(SO32-)+c( OH-)=c(H+)+c(H2SO3) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com