
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×109
C.1∶20∶1010∶109 D.1∶10 ∶104∶109
A
【解析】
试题分析:H2SO4溶液抑制水的电离,分析其中水的电离计算其中氢氧根;Ba(OH)2溶液抑制水的电离,分析其中水的电离计算其中氢离子;Na2S溶液、NH4NO3溶液促进水的电离,根据PH可直接求出发生电离的水的物质的量。设溶液的体积为1L,①pH=0的H2SO4中c(H+)=1.0 mol?L-1,c(OH-)=1.0×10-14mol?L-1,水电离的物质的量为1.0×10-14mol;②0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol?L-1,c(H+)=1.0×10-13mol?L-1,水电离的物质的量为1.0×10-13mol;③pH = 10的Na2S溶液中c(OH-)=1.0×10-4mol?L-1,水的电离的物质的量为1.0×10-4mol;④pH=5的NH4NO3溶液中c(H+)=1.0×10-5mol?L-1,水的电离的物质的量为1.0×10-5mol;①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,选A。
考点:考查水的电离分析。


科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则下列说法正确的组合是
A | B |
C |
|
①B、C形成的单质均存在同素异形体 ②X的种类比Y多
③常温下,B的氢化物不能电离出H+ ④C的最高价氧化物对应的水化物是强酸( )
A.①②③④ B.②④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:填空题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
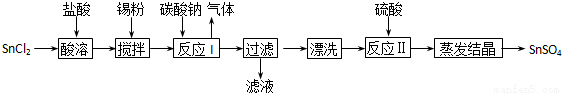
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol?L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
下列选项合理的是( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010 mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42- B.CrO42-、Br-、Cl- C.Br-、Cl-、CrO42- D.Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)= 6.8×10 - 4 mol·L-1、 Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)= 6.4×10 - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN溶液 B.HF溶液 C.CH3COOH溶液 D.HNO2溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是
A.负极反应式为:H2+2OH- -2e- =2H2O
B.正极反应式为:O2 +4H+十4e- =2H2O
C.工作一段时间后,KOH溶液的浓度不变
D.电池工作时,电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.聚乙烯塑料可作食品包装袋
B.乙醇和葡萄糖分子中都含有羟基
C.乙烯和苯都能发生氧化反应
D.C5H12有两种同分异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(3分)科学家一直致力于“人工固氮” 的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个1L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为1 mol·L-1,并放出Q kJ热量,该反应的热化学方程式可表示为 ____ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com