
| A. | 铝表面易形成一层致密的氧化膜保护层,故铝可以广泛用于制造炊具和包装食品 | |
| B. | 5.6gFe在纯氧中燃烧和与足量水蒸气反应,转移电子的物质的量均为$\frac{0.8}{3}$mol | |
| C. | 金属钠在空气中燃烧得到白色固体 | |
| D. | 钠着火时,可直接用水灭火 |
分析 A.氧化铝为致密的结构,但Al及其化合物不宜在食品业使用;
B.根据n=$\frac{m}{M}$计算出铁的物质的量,Fe在纯氧中燃烧和与足量水蒸气反应都生成四氧化三铁,根据电子守恒计算转移电子;
C.钠在空气中氧气燃烧生成淡黄色的过氧化钠;
D.金属钠化学性质活泼,能够与水反应生成氢气.
解答 解:A.氧化铝为致密的结构,但Al元素影响人的智力发育等,则铝不能广泛用来制造炊具和包装食品,故A错误;
B.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,Fe在纯氧中燃烧和与足量水蒸气反应都生成四氧化三铁,四氧化三铁中Fe元素的化合价为+$\frac{8}{3}$,根据电子守恒,转移电子的物质的量为:$\frac{8}{3}$×0.1mol=$\frac{0.8}{3}$mol,故B正确;
C.金属钠在空气中不加热反应生成氧化钠,若燃烧得到淡黄色的过氧化钠,故C错误;
D.金属钠与水反应生成可燃气体氢气,无法达到灭火目的,可用砂子灭火,故D错误;
故选B.
点评 本题考查常见金属及其化合物性质,为高频考点,把握物质的性质、化学与生活的关系等为解答的关键,综合性较强,题目难度不大,充分考查了学生的灵活应用基础知识的能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A酸比B酸的电离程度小 | |
| B. | A是强酸,B是弱酸 | |
| C. | pH=1时,B酸的物质的量浓度比A酸大 | |
| D. | 将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 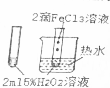 验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 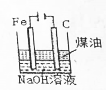 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  验证盐酸、碳酸、苯酚酸性的强弱 | |
| D. |  制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:实验题
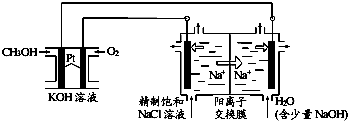
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
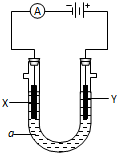 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com