
A、 |
B、 |
C、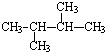 |
D、 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、Na2S水溶液在空气中变浑浊 |
| B、生活中使用明矾净水,除去水中的悬浮颗粒 |
| C、溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D、漂白粉漂白有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、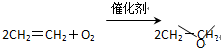 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
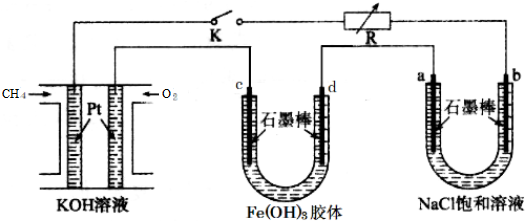
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 |
| B、将铝片改为铝粉,做铝与氧气反应的实验 |
| C、在K2SO4与BaCl2两溶液反应时,增大压强 |
| D、Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com