
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成电池,①②相连时,电路电流从②流向①;①③相连时,③为正极,②④相连时,②有气泡逸出现,③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 15g甲基(CH3-)中含有电子的数目为10mol
B. 煤的干馏和石油的分馏都是化学变化
C. 可用溴水鉴别四氯化碳和己烷两种无色液体
D. 苯既不能使溴水褪色也不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学的规角分析,下列说法不正确的是
A.锂离子电池是一种生活中常用的化学电源
B.纳米材料可用于制造不用洗的衣服面料
C.水中加入“催化剂”,可变成汽车燃料“油”
D.科学家未研发出只加水就能跑的“水氢发动机”汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+ . 将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
A.2.24g
B.3.36g
C.5.60g
D.10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A(g)+B(g)![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
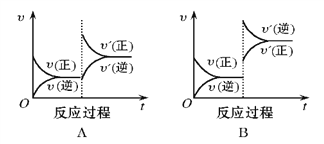
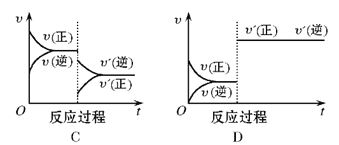

(1)升温,达到新平衡的是_________,新平衡中C的体积分数_________(填增大、减小或不变,下同) 。
(2)降压,达到新平衡的是__________,A的转化率__________。
(3)增加A的量,达到新平衡的是__________,此时B的转化率__________。
(4)使用催化剂,达到平衡的是__________, C的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A+2B(g)![]() nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:
nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:
(1)当n=3时,增压,平衡不移动,则A为______态。
(2)若A为固态,增大压强,C的组分含量增加,则n_________,反应的平衡常数__________(填增大、减小或不变)。
(3)升温,平衡向右移动,达到新平衡前,υ正 ______υ逆(填>、< 或 =),则该反应的逆反应为_______热反应,反应的平衡常数__________(填增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
B.用过量氨水吸收工业尾气中的SO2:2NH3?H2O+SO2=2NH4++SO32﹣+H2O
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2C1﹣
Cu2++2C1﹣
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:提示:(Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)
(1)参加反应的硫酸的物质的量.
(2)生成的SO2的体积(标准状况下).
(3)将反应后的溶液用水稀释到100mL,计算硫酸铜溶液的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
(1)除铁锈(主要成分为Fe2O3),写出反应原理的离子方程式;
(2)制备硅胶,工业上可利用水玻璃和盐酸反应制备硅酸后,进一步处理可得到硅胶,写出水玻璃和盐酸反应的化学方程式;
(3)制氯气,实验室可以利用浓盐酸和高锰酸钾常温下反应来制取氯气, 反应同时还生成了MnCl2、KCl和H2O,写出该反应的化学方程式 , 在此反应中盐酸表现出了性.
(4)工业上可以利用如图所示装置制备盐酸,首先向(填A或B)管中通入氢气并点燃,然后再向(填A或B)管中通入氯气进行反应,此时火焰的颜色为 , 这样操作的理由是 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com