
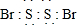 ;
;分析 (1)含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
(2)根据元素守恒、原子守恒知,A为S2Br2,每个Br原子和每个S原子形成一对共用电子对,该分子中所有原子都达到8电子稳定结构;
(3)根据反应物和生成物书写化学方程式.
解答 解:(1)含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,该分子中只含共价键,为共价化合物,故答案为:共价;
(2)根据元素守恒、原子守恒知,A为S2Br2,每个Br原子和每个S原子形成一对共用电子对,该分子中所有原子都达到8电子稳定结构,其电子式为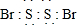 ,故答案为:
,故答案为: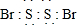 ;
;
(3)根据反应物和生成物书写化学方程式,该反应方程式为4KBr+4SO2=Br2+S2Br2+2K2SO4,故答案为:4KBr+4SO2=Br2+S2Br2+2K2SO4.
点评 本题考查化合物类型判断、电子式的书写、化学方程式书写等知识点,为高频考点,侧重考查学生分析判断及获取信息解答问题能力,难点是A电子式的书写,根据每个原子都达到8电子稳定结构正确确定元素位置,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
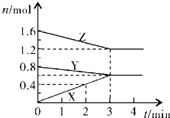 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.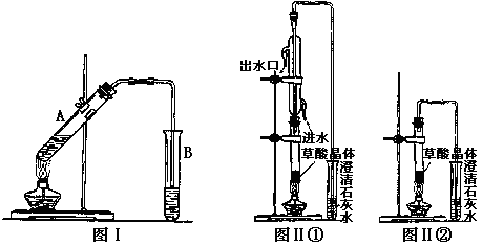
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
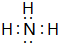 .
.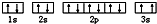 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com