
某反应由两步反应A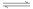 B
B C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
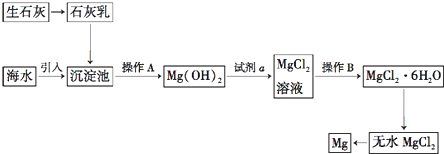
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.2NA个NH3分子的质子数NA | |
| B. | 1mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 7.1g Cl2变为氯离子时,得到的电子数一定为0.1NA | |
| D. | 1L 0.2mol/L硫酸铁溶液中含有的SO${\;}_{4}^{2-}$离子数目为0.2NA. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:推断题
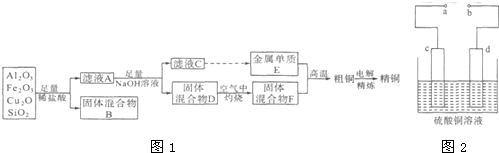
下列各种物质中,除B、D两种物质外,其余各物质均由短周期元素组成。已知常温常压下A为无色无味液体,B、C、G属于金属单质,化合物F的焰色反应为黄色火焰,常温下0.1mol/L的F溶液pH=13,D为黑色有磁性的氧化物。上述物质之间存在如图1所示的转化关系(略去部分反应条件)。
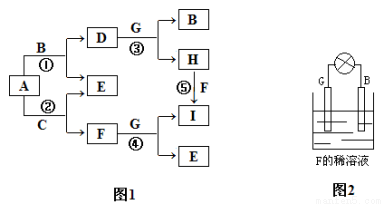
回答下列问题:
(1)写出F的电子式 ;
(2)组成G的元素在周期表中的位置是 ;
(3)写出反应①的化学方程式: ;
(4)写出反应⑤的离子方程式: ;
(5)由B、G、F溶液组成如图2所示的装置,其中G上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH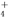 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强
A.①②③ B.①③⑤ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com