

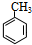
 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$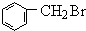 +HBr
+HBr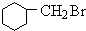 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$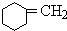 +NaBr+H2O
+NaBr+H2O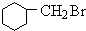 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$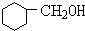 +NaBr.
+NaBr. 分析 A为分子式为C7H8的芳香烃,则A为 ,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为
,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为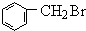 ,C为
,C为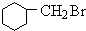 ,D为
,D为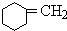 ,E为
,E为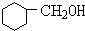 .
.
解答 解:A为分子式为C7H8的芳香烃,则A为 ,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为
,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为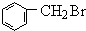 ,C为
,C为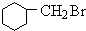 ,D为
,D为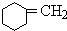 ,E为
,E为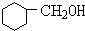 .
.
(1)A的名称是甲苯,故答案为:甲苯;
(2)①的反应类型是:取代反应.③的反应类型是消去反应,故答案为:取代反应;消去反应;
(3)B(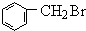 )中卤素原子的检验方法:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素,
)中卤素原子的检验方法:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素,
故答案为:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素;
(4)反应①的化学方程式是: +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$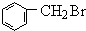 +HBr,
+HBr,
反应③的化学方程式是: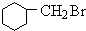 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$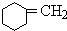 +NaBr+H2O,
+NaBr+H2O,
反应④的化学方程式是: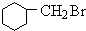 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$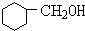 +NaBr,
+NaBr,
故答案为: +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$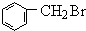 +HBr;
+HBr;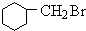 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$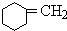 +NaBr+H2O;
+NaBr+H2O;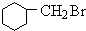 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$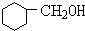 +NaBr.
+NaBr.
点评 本题考查有机物的推断,涉及芳香烃、卤代烃的性质与转化,注意根据反应条件判断发生的反应,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 | |
| D. | 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-不能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和浓硝酸反应 | |
| B. | 铜和稀硝酸反应 | |
| C. | 铜与空气中氧气反应得氧化铜,然后氧化铜和硝酸反应 | |
| D. | 铜和硝酸银反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
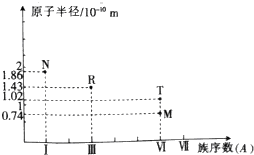
| A. | 常压下,单质R的熔点高于单质M的熔点 | |
| B. | R、T的简单离子都会破坏水的电离平衡 | |
| C. | N2M2与R2M3中所含化学键的类型完全相同 | |
| D. | N、R、T的最高价氧化物对应的水化物之间能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com