
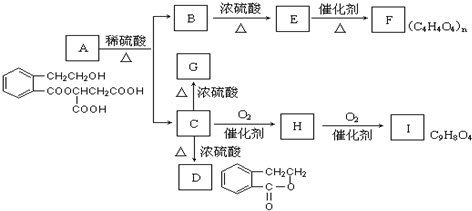
 与
与 ,1molB与2molNaHCO3反应,故B为
,1molB与2molNaHCO3反应,故B为 ,C为
,C为 ,C氧化生成H,D氧化生成I,1molI可与2molNaHCO3反应,故H为
,C氧化生成H,D氧化生成I,1molI可与2molNaHCO3反应,故H为 ,I为
,I为 .C在浓硫酸、加热条件下生成G,G可使溴的四氯化碳溶液褪色,C发生消去反应生成G,则G为
.C在浓硫酸、加热条件下生成G,G可使溴的四氯化碳溶液褪色,C发生消去反应生成G,则G为 .C发生分子内酯化反应形成环酯D.B在浓硫酸作用下生成E,E可使溴的四氯化碳溶液褪色,1molE可与2molNaHCO3,应是B发生消去反应生成E,则E为HOOCCH=CHCOOH,E在催化剂条件下生成F,结合F的结构简式可知,E发生加聚反应生成F,故F为
.C发生分子内酯化反应形成环酯D.B在浓硫酸作用下生成E,E可使溴的四氯化碳溶液褪色,1molE可与2molNaHCO3,应是B发生消去反应生成E,则E为HOOCCH=CHCOOH,E在催化剂条件下生成F,结合F的结构简式可知,E发生加聚反应生成F,故F为 ,据此解答.
,据此解答. 与
与 ,1molB与2molNaHCO3反应,故B为
,1molB与2molNaHCO3反应,故B为 ,C为
,C为 ,C氧化生成H,D氧化生成I,1molI可与2molNaHCO3反应,故H为
,C氧化生成H,D氧化生成I,1molI可与2molNaHCO3反应,故H为 ,I为
,I为 .C在浓硫酸、加热条件下生成G,G可使溴的四氯化碳溶液褪色,C发生消去反应生成G,则G为
.C在浓硫酸、加热条件下生成G,G可使溴的四氯化碳溶液褪色,C发生消去反应生成G,则G为 .C发生分子内酯化反应形成环酯D.B在浓硫酸作用下生成E,E可使溴的四氯化碳溶液褪色,1molE可与2molNaHCO3,应是B发生消去反应生成E,则E为HOOCCH=CHCOOH,E在催化剂条件下生成F,结合F的结构简式可知,E发生加聚反应生成F,故F为
.C发生分子内酯化反应形成环酯D.B在浓硫酸作用下生成E,E可使溴的四氯化碳溶液褪色,1molE可与2molNaHCO3,应是B发生消去反应生成E,则E为HOOCCH=CHCOOH,E在催化剂条件下生成F,结合F的结构简式可知,E发生加聚反应生成F,故F为 ,
, ,C为
,C为 ,结合A的结构简式,可知A、B、C中所含相同官能团的名称为:羧基、醇羟基.由上述分析可知,F为
,结合A的结构简式,可知A、B、C中所含相同官能团的名称为:羧基、醇羟基.由上述分析可知,F为 ,I为
,I为 ,
, ;
; ;
; ,C→G是
,C→G是 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成 ,故答案为:加聚反应;消去反应;
,故答案为:加聚反应;消去反应;
| 浓硫酸 |
| △ |
 +O2
+O2| 催化剂 |
| △ |
 +2H2O,
+2H2O,
| 浓硫酸 |
| △ |
 +O2
+O2| 催化剂 |
| △ |
 +2H2O;
+2H2O; )互为同分异构体且满足下列条件:
)互为同分异构体且满足下列条件: ,
, .
.


科目:高中化学 来源: 题型:
| A、③⑥ | B、①③⑥ |
| C、①③④⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
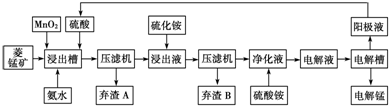
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com