
【题目】中学教材中常见的金属和非金属元素及其化合物在工业和生活中有重要应用,请回答下列问题:
(1)从海水中提溴是将Cl2:通入浓海水中,生成溴单质,而氯气氧化溴离子是在酸性条件下进行的,其目的是避免__________________。
(2)ClO2是高效、低毒的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为____。
(3)磷的含氧酸有多种形式,如H3 PO4 、H3PO2(次磷酸)、H3PO3(亚磷酸)等。H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,写出H3PO3的第二步电离方程式_________________。H3PO3和碘水反应,棕黄色褪去,再滴加AgNO3溶液,有黄色沉淀生成:请写出H3PO3和碘水反应的化学方程式____。
(4)高铁酸钾(K2FeO4)是一种新型高效水处理剂,其中Fe元素的化合价是____:高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的物质。用一个离子方程式表示高铁酸钾处理水的过程____。
(5)镁一H2O2酸性燃料电池的反应机理为Mg+H2O2 +2H+==Mg2++2H2O,则正极反应式为________。常温下若起始电解质溶液pH =1,则pH =2时溶液中Mg2+浓度为________。已知Ksp[ Mg(OH)2]=5.6×10 -12,当溶液pH =6时,_____(填“有”或“没有”)Mg( OH)2沉淀。
【答案】 Cl2歧化生成HC1和HC1O 2:1 H2PO3![]() H+ + HPO32- H3PO3+I2+H2O=H3PO4+2HI +6 4FeO42-+l0H2O=4Fe (OH)3(胶体)+3O2↑+8OH- H2O2+2H++2e- =2H2O 0. 045 mol /L 没有
H+ + HPO32- H3PO3+I2+H2O=H3PO4+2HI +6 4FeO42-+l0H2O=4Fe (OH)3(胶体)+3O2↑+8OH- H2O2+2H++2e- =2H2O 0. 045 mol /L 没有
【解析】(1)氯气能与水反应生成HCl与HClO,酸性条件下避免Cl2发生歧化反应生成HCl和HClO,故答案为:Cl2发生歧化反应生成HCl和HClO;
(2)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;
(3)H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,说明HPO32-不能继续电离出氢离子,H3PO3的第二步电离方程式为H2PO3![]() H+ + HPO32-,H3PO3和碘水反应,棕黄色褪去,亚磷酸被氧化生成磷酸,再滴加AgNO3溶液,有黄色沉淀AgI生成,则H3PO3和碘水反应的化学方程式为H3PO3+I2+H2O=H3PO4+2HI,故答案为:H2PO3
H+ + HPO32-,H3PO3和碘水反应,棕黄色褪去,亚磷酸被氧化生成磷酸,再滴加AgNO3溶液,有黄色沉淀AgI生成,则H3PO3和碘水反应的化学方程式为H3PO3+I2+H2O=H3PO4+2HI,故答案为:H2PO3![]() H+ + HPO32-;H3PO3+I2+H2O=H3PO4+2HI;
H+ + HPO32-;H3PO3+I2+H2O=H3PO4+2HI;
(4)K2FeO4中K为+1价,O为-2价,根据正负化合价的代数和为0,有Fe的化合价为+6价;高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的物质,即生成Fe(OH)3胶体,反应离子方程式为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:+6;4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-;
(5)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到c(Mg2+)=![]() c(H+)减小=0.045mol/L;Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时,c(OH-)=10-7mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-14mol/L=4.5×10-16<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;故答案为:H2O2+2H++2e-=2H2O;0.045 molL-1;没有。
c(H+)减小=0.045mol/L;Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时,c(OH-)=10-7mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-14mol/L=4.5×10-16<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;故答案为:H2O2+2H++2e-=2H2O;0.045 molL-1;没有。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言,化学用语具有简便、确切地表达化学知识和化学思维的特点.下列化学用语中书写正确的是
A. 氯离子的结构示意图:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型:![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 恒容密闭容器中 3种气态物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示:

(1)该反应的化学方程式是___________________________________.
(2)当反应到 t分钟时 ,v(X)正__________v(X)逆(填“大于”、“小于”或“等于”), 若 t=3min,Y 的平均反应速率是___________________.
(3)反应到 t 分钟时,X的物质的量浓度是___________,X的转化率是_________。若此时刻保持温度和容器压强不变,向容器中充入稀有气体,则X的转化率将_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Mg2+、H+、C1-、OH-B.K+、Ca2+、NO3-、CO32-
C.Mg2+、Na+、SO42-、Cl-D.Na+、H+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有5瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、葡萄糖中的一种。现通过如下实验来确定各试剂瓶中所装液体的名称:
实验步骤和方法 | 实验现象 |
①把5瓶液体分别依次标号A、B、C、D、E,然后闻气味 | 只有E没有气味 |
②各取少量于试管中 ,加水稀释 | 只有C、D不溶解而浮在水面上 |
③分别取少量5种液体于试管中,加新制Cu(OH)2并加热 | 只有B使沉淀溶解,E中产生砖红色沉淀 |
④各取C、D少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(1)写出这6种物质的名称。
A____________ B____________ C____________ D____________ E____________
(2)在D中加入NaOH溶液并加热的化学方程式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A .10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B.当反应达到平衡时,SO3的物质的量可能为0.4mol
C.档SO2和O2的生成速率之比为2:1时,达到该反应限度
D.向容器内充入SO2,可以提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的工业制备方法合理的是
A. 制Si:SiO2![]() SiCl4
SiCl4![]() Si
Si
B. 制H2SO4:黄铁矿![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
C. 卤水中提取Mg:卤水(主要含MgCl2) ![]() Mg(OH)2
Mg(OH)2![]() …
…![]() MgCl2
MgCl2![]() Mg
Mg
D. 侯氏制碱法:饱和食盐水![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏伽德罗常数,下列说法中正确的是( ) ①常温常压下,17g甲基(﹣14CH3)所含的中子数为9NA
②常温常压下,22.4L NO气体的分子数小于NA
③室温下,28.0g乙烯和丙烯的混合气体中含有的共价键约为3×6.02×1023个
④7.2g CaO2中含有的阴离子数目约为6.02×1022
⑤标准状况时,22.4L氟化氢所含有的原子数为2NA
⑥标况下,7.8g苯中含有碳碳双键的数目为0.3NA .
A.①②⑥
B.②④⑤
C.②④
D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A合成聚酯类高分子化合物F的路线如下图所示:

已知:RCH=CH3 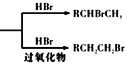
(1)A、C中含氧官能团的名称分别为_______,A生成B的反应类型为_________。
(2)D与NaOH水溶液反应的化学方程式为_________________________________。
(3)①E生成F的化学方程式为_____________________________________________。
②若F的平均相对分子质量为20000,则其平均聚合度为_____(填字母代号)。
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环结构的G,则G的结构简式为____________。
(5)满足下列条件的C的同分异构体有____种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(6)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物![]() 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示: 目标产物。__________________
目标产物。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com