
| A、在熔融电解质中,O2-由负极移向正极 |
| B、电池的总反应是2C4H10+13O2→8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为O2+4e-→2O2- |
| D、通入丁烷的一极是负极,电极反应为C4H10+13O2-→4CO2+5H2O+26e- |


科目:高中化学 来源: 题型:
| A、焰色反应鉴别NaCl和NaNO2 |
| B、SiO2与H2O反应制取H2SiO3 |
| C、用氯气与烧碱溶液制备漂白粉 |
| D、用萃取的方法从碘的饱和水溶液中分离出碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
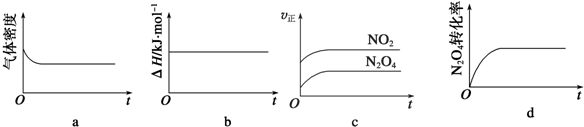
| A、ab | B、bc | C、ac | D、ad |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | O3 | 水 | 硫酸 | 纯碱 | 胆矾 |
| B | 黄铜 | NO2 | 盐酸 | 石灰水 | FeSO4 |
| C | 碘酒 | 一氧化碳 | 磷酸 | NH3?H2O | 食盐 |
| D | H2 | Fe3O4 | HNO3 | 烧碱 | 小苏打 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
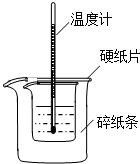 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 5 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com