
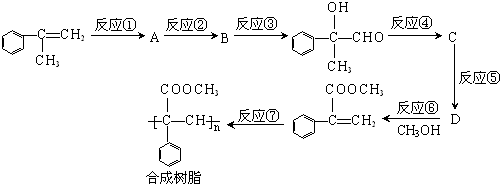
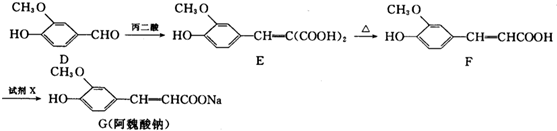
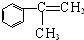 经过系列反应得到
经过系列反应得到 ,可以先与溴发生加成反应生成A,A在氢氧化钠水溶液、加热条件下发生取代反应生成B,B再发生氧化反应生成
,可以先与溴发生加成反应生成A,A在氢氧化钠水溶液、加热条件下发生取代反应生成B,B再发生氧化反应生成 ,B为
,B为 ,由反应⑥D与甲醇生成
,由反应⑥D与甲醇生成 可知D为
可知D为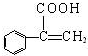 ,故C发生消去反应生成D,则C为
,故C发生消去反应生成D,则C为 ,
, 再发生加聚反应生成高聚物,据此解答.
再发生加聚反应生成高聚物,据此解答.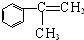 经过系列反应得到
经过系列反应得到 ,可以先与溴发生加成反应生成A,A在氢氧化钠水溶液、加热条件下发生取代反应生成B,B再发生氧化反应生成
,可以先与溴发生加成反应生成A,A在氢氧化钠水溶液、加热条件下发生取代反应生成B,B再发生氧化反应生成 ,B为
,B为 ,由反应⑥D与甲醇生成
,由反应⑥D与甲醇生成 可知D为
可知D为 ,故C发生消去反应生成D,则C为
,故C发生消去反应生成D,则C为 ,
, 再发生加聚反应生成高聚物,
再发生加聚反应生成高聚物, ,D结构简式为:
,D结构简式为: ,故答案为:
,故答案为: ;
; ;
;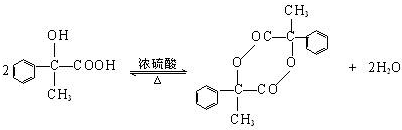 ,
, ;
; )的同分异构体满足下列条件:①能使FeCl3溶液显紫色,含有酚羟基;②苯环上有两个取代基;③能发生银镜反应,含有醛基,故侧链为-OH、-CH=CHCHO或为-OH、-C(CHO)=CH2,各有邻、间、对3种位置,故共有6种,故答案为:6.
)的同分异构体满足下列条件:①能使FeCl3溶液显紫色,含有酚羟基;②苯环上有两个取代基;③能发生银镜反应,含有醛基,故侧链为-OH、-CH=CHCHO或为-OH、-C(CHO)=CH2,各有邻、间、对3种位置,故共有6种,故答案为:6.


科目:高中化学 来源: 题型:
| A、将10g氢氧化铁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化铁溶液,c(OH-)=3×10-10mol/L |
| B、将10g氢氧化镁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化镁溶液,加入酚酞试液后不能变红 |
| C、若1mol/L氯化镁溶液中混有氯化铁,调节pH=9,可以保证镁离子不沉淀而铁离子沉淀完全 |
| D、根据溶度积数据,可以计算出氢氧化铁固体与盐酸反应:Fe(OH)3+3H+?Fe3++3H2O的平衡常数为2.7×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
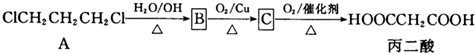
| 丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com