
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是
| A.HCl(g)+NH3(g)= NH4Cl(s) |
| B.2KClO3(s)=2KCl(s)+3O2(g) |
| C.2Na2O2(s)+2H2O(l)=4NaOH(s)+O2(g) |
| D.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+ 2NH3(g)+10H2O(l) |
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 |
| B.催化剂可以加快化学反应速率但不能改变化学反应的焓变 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
D.对于反应2SO2(g)+O2(g)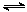 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学用以下实验用品设计验证碘化钾与氯化铁反应的限度:0.1mol·L–1KI溶液、0.1mol·L–1FeCl3溶液、CCl4、淀粉溶液、KSCN溶液、试管、胶头滴管等。该同学设计的实验方案如图:
根据以上实验方案判断下列说法不正确的是
| A.试剂a是0.1mol·L–1KI溶液 |
| B.试剂d是KSCN溶液 |
| C.说明该反应已经发生的理由是③的下层呈紫色 |
| D.说明该反应是有限度的实验现象是④的上层溶液出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是
A.单位时间内消耗amolA,同时生成3amolC
B.混合气体的物质的量不再变化
C.2v(C)正=3v(B)逆
D.容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
| 组号 | 反应温 度/℃ | Na2S2O3 | H2SO4 | H2O体积/mL | ||
| 体积/mL | 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | |||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两体积的密闭容器中均充入1mol X和1mol Y,分别用于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在 时刻改变了某一实验条件。下列判断正确的是
时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 | B.正反应是吸热反应 |
C. 时刻可能是增大了压强 时刻可能是增大了压强 | D. 时刻可能是降低了温度 时刻可能是降低了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L |
| B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L |
| D.SO3为0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com