
【题目】把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝的质量分数_______;
(2)该合金中铝和镁的物质的量之比_______;
(3)若向反应后的溶液中加入足量的NaOH溶液,最终能产生沉淀_______克?
【答案】52.9% 1∶1 5.8
【解析】
根据盐酸过量,则镁、铝都完全反应,根据金属的质量关系和得失电子守恒来列式计算Mg、Al的各自物质的量,根据m=nM计算Al的质量,进而计算Al的质量分数;向反应后的溶液中加入足量的NaOH溶液,最终产生的沉淀为氢氧化镁,根据Mg原子守恒n[Mg(OH)2])=n(Mg),再根据m=nM计算其质量。
标准状况下,氢气的物质的量为![]() =0.25mol,因盐酸足量,金属完全反应,设镁、铝的物质的量分别为x mol和y mol,则:24x+27y=5.1,2x+3y=0.25×2,解得x=0.1,y=0.1mol。
=0.25mol,因盐酸足量,金属完全反应,设镁、铝的物质的量分别为x mol和y mol,则:24x+27y=5.1,2x+3y=0.25×2,解得x=0.1,y=0.1mol。
(1)铝的质量分数为![]() ×100%=52.9%,答:该合金中铝的质量分数为52.9%;
×100%=52.9%,答:该合金中铝的质量分数为52.9%;
(2)该合金中镁和铝的物质的量之比为0.1mol∶0.1mol=1∶1,答:该合金中镁和铝的物质的量之比为1∶1;
(3)向反应后的溶液中加入足量的NaOH溶液,因为氢氧化铝为两性氢氧化物,能够被氢氧化钠溶解,因此最终产生的沉淀为氢氧化镁,根据Mg原子守恒n[Mg(OH)2])=n(Mg)=0.1mol,故氢氧化镁沉淀的质量=0.1mol×58g/mol=5.8g,答:生成沉淀的质量为5.8g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列互为同分异构体的是( )
A.CH4与CH3CH2CH3B.CH3CH2CH2CH3与CH3CH(CH3)2
C.H2O与D2OD.金刚石和石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃ 时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) ![]() xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C平均反应速率为__________。
(2)x=__________;平衡常数K=____________。
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)____。
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是

A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素的化合价有+2和+3价,某兴趣小组利用含铁的盐溶液进行化学实验:
(1)取一定量氯化亚铁固体,配制成0.1mol/L 的溶液,在FeCl2溶液中需加入少量铁屑,其目的是_______________。
(2)在氯化铁溶液中滴入1滴KSCN溶液,溶液变________色,接着在变色的溶液中滴入2 mL 0.5mol/L AgNO3溶液,产生白色沉淀(已知:AgSCN为白色沉淀) ,溶液逐渐恢复到原来颜色,这种变化是因为________________________________________(请从平衡移动的角度解释)。
用下图装置进行SO2性质的研究。

(3)用______取25.00mL FeCl3和Ba(NO3)2的混合溶液,通入SO2气体一段时间后,发现A中产生白色沉淀,该白色沉淀的化学式是______,推测产生白色沉淀的原因可能是_____________
(4)工业石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________吨石膏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应,最终一定能得到白色沉淀的是( )
A.向CaCl2溶液中通入少量CO2
B.向CuSO4溶液中加入足量NaOH溶液
C.向FeCl2溶液中加入足量NaOH溶液
D.向MgSO4溶液中加入足量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着现代工业的发展,二氧化碳污染的处理成为科学研究的重点,回答下列问题:
I.有人提出利用H2还原CO2使其转化为有机化工的主要原料乙烯。
(1)查阅资料:H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为l41lkJ/mol,lmolH2O(1)转化为H2O(g)需吸收44kJ的热量。则反应6H2(g)+2CO2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
△H=___________kJ/mol。
(2)下图是探究不同温度对CO2的转化率和催化剂的催化效率影响的示意图。

①生产中通常选用的温度最好是___________,理由是___________。
②图中表示的化学平衡常数:M___________N(填>、=、<)
③250℃时,在2L密闭容器中分别充入6molH2和2 molCO2,到达平衡时体系中C2H4的体积分数为___________。
Ⅱ.CO在一定条件下,能与H2合成二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
(1)在1L的密闭容器中分别充入2.5molH2与 bmol CO2发生反应,在不同温度下达到平衡状态时测得实验数据如下表:

①到达平衡时若升高温度,则上述平衡___________方向移动(填“正反应”或“逆反应”)。
②转化率:x___________y(填>、=、<)
(2)新型高效的二甲醚燃料电池工作时总反应式:CH3OCH3+3O2=2CO2+3H2O。
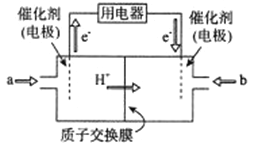
①该电池的负极是___________(填a或b),负极电极反应式为___________;
②利用该电池冶铝,若制得金属铝54g理论上消耗二甲醚___________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com