
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
分析 A.常温下,CH3COONH4溶液的pH=7,可知醋酸根离子、铵根离子水解程度相同;
B.CaSO4可用饱和Na2CO3溶液浸泡,转化为碳酸钙沉淀;
C.向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶质为NaCl;
D.CH3COONa溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{h}}{c({H}^{+})}$,升高温度促进水解,Kh增大,c(H+)减小.
解答 解:A.常温下,CH3COONH4溶液的pH=7,可知醋酸根离子、铵根离子水解程度相同,则等温等浓度的CH3COOH和NH3•H2O的电离度相等,故A正确;
B.CaSO4可用饱和Na2CO3溶液浸泡,转化为碳酸钙沉淀,稀盐酸可溶解除去碳酸钙,故B错误;
C.向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶质为NaCl,溶液中不存在溶液中CO32-、HCO3-,故C错误;
D.CH3COONa溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{h}}{c({H}^{+})}$,升高温度促进水解,Kh增大,c(H+)减小,则$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$增大,故D错误;
故选A.
点评 本题考查酸碱混合、盐类水解及沉淀生成,为高频考点,把握水解与电离、沉淀转化及应用等为解答的关键,侧重分析与应用能力的考查,选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (4) | ||
| (2) | (5) | ||
| (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
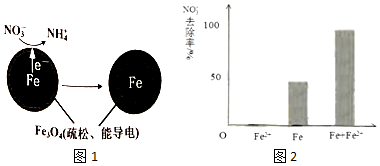
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2和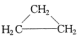 | B. | 乙炔和苯 | C. |  和 和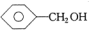 | D. | 乙酸和甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
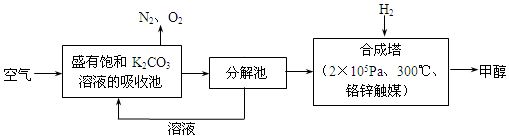

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com