
分析 (1)Cu2S与KMnO4酸性溶液反应高锰酸钾做氧化剂氧化Cu2S反应生成硫酸铜、氯酸钾、硫酸锰和水;
(2)步骤3中加入氨水的目的为除掉铁离子,如果未加入氨水,铁离子也会氧化碘离子生成碘单质;
(3)溶液的pH=2.0,则c(OH-)=10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)计算;
(4)设Cu2S和CuS的物质的最分别为x、y,根据2Cu2+~I2~2S2O32-,利用原子守恒列式求出Cu2S和CuS的物质的量、质量,再求出质量分数.
解答 解:(1)Cu2S与KMnO4酸性溶液反应高锰酸钾做氧化剂氧化Cu2S反应生成硫酸铜、氯酸钾、硫酸锰和水,反应的化学方程式为:Cu2S+2KMnO4+4H2SO4=K2SO4+2MnSO4+2CuSO4+4H2O,
故答案为:Cu2S+2KMnO4+4H2SO4=K2SO4+2MnSO4+2CuSO4+4H2O;
(2)步骤3中加入氨水的目的为除掉Fe3+,避免Fe3+与I-反应,影响对Cu2+含量的测定,如果未加入氨水,铁离子也能氧化碘离子生成碘单质,则测得的Cu2+的物质的量将偏高,混合固体中CuS减小,混合固体中CuS的质量分数将偏低,
故答案为:除掉Fe3+,避免Fe3+与I-反应,影响对Cu2+含量的测定;偏高;偏低;
(3)步骤3加入氨水产生沉淀时,溶液的pH=2.0,则c(OH-)=10-12mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.6×10-39,
则溶液中c(Fe3+)=$\frac{2.6×1{0}^{-39}}{(1{0}^{-12})^{3}}$=2.6×10-3mol/L
故答案为:2.6×10-3mol/L;
(4)设Cu2S和CuS的物质的最分别为x、y,
根据关系式2Cu2+~I2~2S2O32-可知:n(Cu2+)=n(S2O32-)=0.050 00 mol•L-1×14.00×10-3 L=7.000×10-4 mol,
则:2x+y=7.000×10-4 mol×$\frac{250ml}{25ml}$…①,
Cu2S和CuS被高锰酸钾氧化为CuSO4,Cu、S元素失去电子的物质的量等于Mn元素得到电子的物质的量,
则10x+8y=0.120 0mol•L-1×0.1L×5-0.100mol•L-1×0.016L×$\frac{250ml}{25ml}$…②,
联立方程式①②,
解得:x=2.000×10-3mol、y=3.000×10-3mol,
试样中Cu2S的质量分数为:w(Cu2S)=$\frac{2.000×1{0}^{-3}mol×160g/mol}{0.7500g}$×100%=42.7%,
试样中CuS的质量分数为:w(CuS)=$\frac{3.000×1{0}^{-3}mol×96g/mol}{0.7500g}$×100%=38.4%,
答:Cu2S的质量分数为42.7%,CuS的质量分数为38.4%.
点评 本题考查了物质组成分析与化学综合计算题,涉及氧化还原反应滴定、溶度积的计算等,难度中等,注意运用元素守恒进行推理计算,学习中紧紧抓住元素守恒、质量守恒、电荷守恒、极端分析等化学常用分析方法.


科目:高中化学 来源: 题型:选择题
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
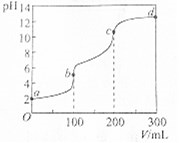 室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | a点溶液的pH=2,草酸溶液的浓度为0.005mol•L-1 | |
| B. | b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-) | |
| C. | b→c段,反应的离子方程式为HC2O4-+OH-═C2O42-+H2O | |
| D. | c→d段,溶液中C2O42-的水解程度逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中不可能含有共价键 | |
| B. | 在共价化合物中也可能含有离子键 | |
| C. | 凡含有离子键的化合物一定是离子化合物 | |
| D. | 完全由非金属元素组成的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com