
| A.打雷时也能产生臭氧,臭氧分子是直线型分子 |
| B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量 |
| C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定 |
| D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解 |
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
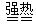 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是| A.有BaSO4生成 | B.有BaSO3生成 |
| C.同时有BaSO4和BaSO3生成 | D.有SO3逸出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
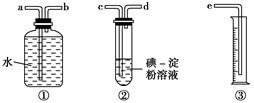
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
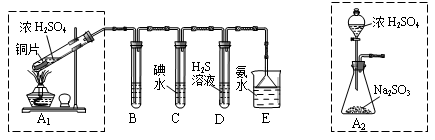
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | 。 |
| 步骤3: 。 | 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
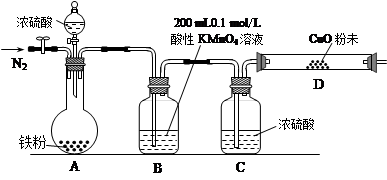
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 |
| B.浓硫酸和浓硝酸都能与金属铜反应 |
| C.浓硫酸和浓硝酸加水稀释后都能与金属铜反应 |
| D.浓硫酸和浓硝酸在常温下都能用金属铝或铁制容器盛放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com