
【题目】室温下,下列指定溶液中微粒的物质的量浓度关系一定正确的是![]()
A.某溶液中由水电离出的![]() ,若
,若![]() 时,该溶液pH一定为
时,该溶液pH一定为![]()
B.向澄清石灰水中通入![]() 至
至![]() 恰好完全反应:
恰好完全反应:![]()
C.![]() 溶液与
溶液与![]() 溶液等体积混合
溶液等体积混合![]() 无气体逸出
无气体逸出![]() :
:![]()
D.![]() 溶液与
溶液与![]() 溶液等体积混合
溶液等体积混合![]() :
:![]()
科目:高中化学 来源: 题型:
【题目】图中反应![]() 是制备
是制备![]() 的一种方法,其副产物
的一种方法,其副产物![]() 是优质的镁资源。回答下列问题:
是优质的镁资源。回答下列问题:
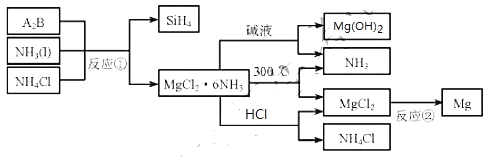
![]() 所含元素的简单离子半径由小到大的顺序
所含元素的简单离子半径由小到大的顺序![]() 除外
除外![]() :______。
:______。
Mg在元素周期表中的位置;______,![]() 的电子式:______。
的电子式:______。
![]() 的化学式为______,反应
的化学式为______,反应![]() 的必备条件是______。上图中可以循环使用的物质有______。
的必备条件是______。上图中可以循环使用的物质有______。
![]() 在一定条件下,由
在一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和一种固体耐磨材料______
和一种固体耐磨材料______![]() 写化学式
写化学式![]() 。
。
![]() 为实现燃煤脱硫,向煤中加入浆状
为实现燃煤脱硫,向煤中加入浆状![]() ,使燃烧产生的
,使燃烧产生的![]() 转化为稳定的Mg化合物,写出该反应的化学方程式:______。
转化为稳定的Mg化合物,写出该反应的化学方程式:______。
![]() 用Mg制成的格氏试剂
用Mg制成的格氏试剂![]()
![]() 常用于有机合成,例如制备醇类化合物的合成路线如下:
常用于有机合成,例如制备醇类化合物的合成路线如下:
RBr![]() RMgBr
RMgBr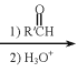
![]()
![]() :烃基;R’:烃基或
:烃基;R’:烃基或![]()
依据上述信息,写出制备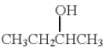 所需醛的可能结构简式:______。
所需醛的可能结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。
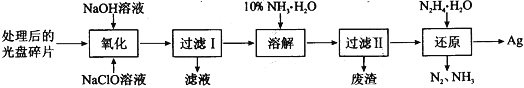
(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性顺序:Cl2>Br2>Fe3+>I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列说法正确的是
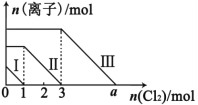
A.线段Ⅰ代表Br-的变化情况
B.线段Ⅲ代表Fe2+的变化情况
C.原混合溶液中n(FeBr2) = 4mol
D.a = 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO + 2NH3 = N2H4 + NaCl + H2O制取。某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O)
5NaCl + NaClO3 + 3H2O)

①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。制取氨气的化学方程式为_______。

(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。写出该反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.50 mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
v(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈0.033 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L·min)
C.反应到6 min时,H2O2分解了40%
D.反应到10 min时,c(H2O2)≈0.24 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、CO32-、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
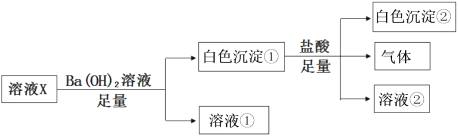
(1)溶液X中一定存在的离子有__________;一定不存在的离子有________。
(2)写出白色沉淀①与足量盐酸反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素 X、Y、Z、M、W 的原子序数与其某常见化合价的关系如图所示,下列关系不正确的是
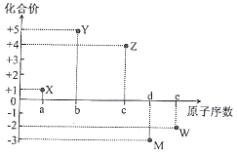
A.元素 X 可能为锂
B.原子半径大小:r(M)>r(W)
C.Z 元素是形成化合物种类最多的元素
D.气态氢化物的还原性:YH3<MH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com