
下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.在K2SO4与BaCl2两溶液反应时,增大压强
C.将铝片改为铝粉,做铝与氧气反应的实验
D.Fe与稀硫酸反应制取氢气时,改用浓硫酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年湖北黄冈中学高一下期中化学试卷(解析版) 题型:填空题
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素名称分别是:A___________,B___________,C___________,D___________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_______________。(用化学式表示,下同)
(3)A与B形成的三原子分子的电子式是___________,B与D形成的原子个数比为l∶l的化合物中含有的化学键类型有___________。
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一6月月考化学试卷(解析版) 题型:选择题
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西金溪一中高一下第二次月考化学试卷(解析版) 题型:简答题
(一)已知断裂1mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ。某有机物分解的反应可表示为:

若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
(二)如图所示的原电池,一段时间后某极析出1.28g的固体。回答下列问题:
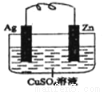
(1)正极是 (填“锌”或“银”),发生了 反应。
(2)正极的电极反应为 。
(3)上述过程中共转移电子 mol。
(4)锌片的质量 (填“增加”或“减少”) g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西金溪一中高一下第二次月考化学试卷(解析版) 题型:选择题
下列各反应属于加成反应的是
A.CH4+2O2 CO2+2H2O
CO2+2H2O
B.CH2=CH2+Br2 CH2Br—CH2Br
CH2Br—CH2Br
C.CH4+Cl2 CH3Cl+HCl
CH3Cl+HCl
D.2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西金溪一中高一下第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个O族,1个VII族,共16个纵行
D.X2+的核外电子数目为18,则X在第四周期第IIA族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一5月月考化学试卷(解析版) 题型:填空题
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为______,B为______,C为______。
(2)E的电子式为 。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:__ ___。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:实验题
氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表 面的油污。
面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、 ,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com