
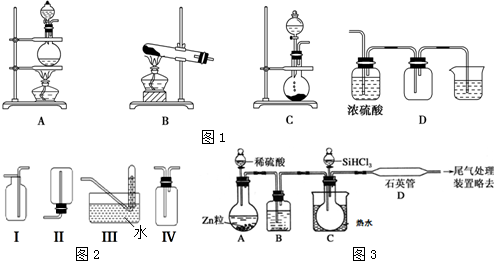
分析 (1)二氧化氮与水发生反应:3NO2 +H2O=2HNO3 +NO,有硝酸生成,导致形成酸雨,反应中二氧化氮既是氧化剂也是还原剂;
(2)若用B装置制取氨气,实验室一般用氯化铵和氢氧化钙固体反应,C装置是液体和固体不需要加热进行的气体制备反应装置;依据氨气密度小于空气密度,极易溶于水选择合适的收集装置;若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理,A装置中反应是二氧化锰浓盐酸加热反应生成氯气、氯化锰和水,溶液中氯化氢和氯化锰全部电离;
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;NaH与液氨(NH3)反应生成NaNH2和H2,依据化学方程式定量关系结合电子守恒计算得到;
(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,氢气易爆炸.
解答 解:(1)二氧化氮与水发生反应:3NO2 +H2O=2HNO3 +NO,有硝酸生成,导致形成酸雨,根据N元素化合价变化,可知其氧化剂的NO2生成NO,起还原剂的NO2生成HNO3,由方程式可知,该反应中氧化剂和还原剂的物质的量之比为1:2,
故答案为:3NO2 +H2O=2HNO3 +NO;1:2;
(2)采用B装置制备氨气时应选择用氢氧化钙和氯化铵固体加热反应,反应方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;C装置适用于固体和液体不加热制气体,制取氨气应选择浓氨水和氧化钙或碱石灰或氢氧化钠固体;氨气密度小于空气密度,极易溶于水,应选择向下排气法收集,不能用排水法收集,收集不能用密封装置,
所以只有Ⅳ符合题意;
若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理;
A.制取CO2时不需要加热也不不必处理尾气,故A错误;
B.NO不能用排空气法收集,故B错误;
C.二氧化锰与浓盐酸加热生成氯气,氯气密度大于空气密度,能够用浓硫酸干燥,氯气可以用氢氧化钠溶液吸收尾气,故C正确;
D.氢气密度小于空气 密度,故D错误;
A装置中反应的离子方程式 MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,
故答案为:?2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O,浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);Ⅳ;C; MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,氢元素化合价升高为+1价,钛元素化合价+4价变化为0价,则反应的化学方程式为:NaH+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl+2H2↑,?NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为?NaH+NH3═NaNH2+H2↑,每反应1molNaH电子转移总数为1mol,如果有12g NaH物质的量=$\frac{12g}{24g/mol}$=0.5mol参加此反应,电子转移0.5mol,
故答案为:TiCl4+4NaH$\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti+2H2↑;?NaH+NH3═NaNH2+H2↑;0.5;
(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
故答案为:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑;高温下H2与O2混合发生爆炸.
点评 本题考查了气体的实验室制备和装置的应用、物质性质、氧化还原反应概念和定量关系,明确气体制备原理是解题关键,侧重考查学生对实验知识掌握的熟练程度,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
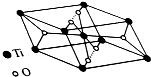 (1)下列说法正确的是AD(填序号)
(1)下列说法正确的是AD(填序号) ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的O2:通过灼热的CuO粉末,收集气体 | |
| B. | 某吸热反应能自发进行,则该反应一定是熵增的反应 | |
| C. |  如图是从化学试剂商店买回的硫酸试剂标签,配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL | |
| D. | 下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关①Na2SiO3+CO2+H2O ②Fe+Cl2 ③Ca(HCO3)2+Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
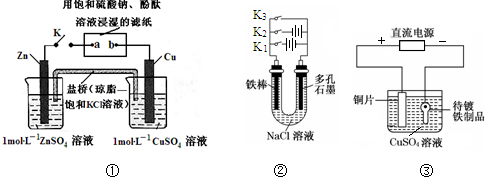
| A. | 装置①中K键闭合时,片刻后可观察到滤纸a点变红色 | |
| B. | 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 | |
| C. | 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 | |
| D. | 装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的粒子一定属于同一种元素 | |
| B. | 同位素的性质几乎完全相同 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 某种元素的相对原子质量取整数,就是其质量数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com