
| A. | 分液、萃取、蒸馏、渗析 | B. | 分液、蒸馏、渗析、萃取 | ||
| C. | 萃取、蒸馏、分液、萃取 | D. | 蒸馏、萃取、渗析、萃取 |
分析 ①乙酸乙酯和乙酸钠溶液,分层;
②甲醇和甘油互溶,但沸点不同;
③葡萄糖和淀粉的混合液,淀粉不能透过半透膜,葡萄糖溶液可以;
④溴化钠和单质溴的水溶液,溴不易溶于水,易溶于有机溶剂,以此来解答.
解答 解:①乙酸乙酯和乙酸钠溶液,分层,则选择分液法分离;
②甲醇和甘油互溶,但沸点不同,则选择蒸馏法分离;
③葡萄糖和淀粉的混合液,淀粉不能透过半透膜,葡萄糖溶液可以,则选择渗析法分离;
④溴化钠和单质溴的水溶液,溴不易溶于水,易溶于有机溶剂,则选择萃取法分离,
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
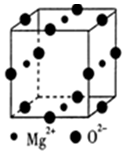 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.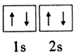 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).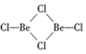 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.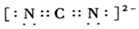 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将溶液不断加水稀释,则水的电离程度增大 | |
| B. | 溶液中各离子浓度大小关系:c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| C. | 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10-5 | |
| D. | 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8 mol•L-1时即能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子越稳定,其熔沸点越高 | |
| B. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| C. | 放热反应都不需要加热就可以进行 | |
| D. | 吸热反应不一定需要加热条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com