
 制取水煤气的反应为C(s)+
制取水煤气的反应为C(s)+
H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
A.加压 B.升温
C.增大水蒸气浓度 D.增大碳的物质的量
科目:高中化学 来源: 题型:
立方烷(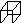 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
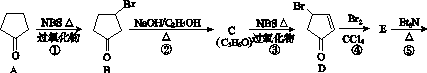
回答下列问题:
(1)C的结构简式为______________,E的结构简式为______________。
(2)③的反应类型为______________,⑤的反应类型为______________。
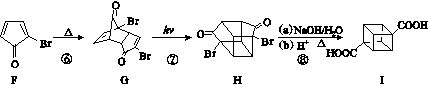
(3)化合物A可由环戊烷经三步反应合成:

反应1的试剂与条件为________;反应2的化学方程式为________________________________________;反应3可用的试剂为________。
(4)在I的合成路线中,互为同分异构体的化合物是________(填化合物代号)。
(5)I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有________个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.施安卡因(G)是一种抗心律失常药物,可由图K303所示路线合成。
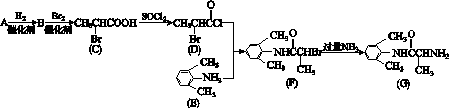
图K303
(1)已知A是CH2CHCOOH的单体,则A中所含官能团的名称是________________。
(2)B的结构简式为__________________;用系统命名法给C命名为______________。
(3)C与足量NaOH醇溶液共热时反应的化学方程式为________________________________________________。F→G的反应类型为____________。
(4)L是E的同分异构体,分子中含有苯环且苯环上的一氯取代物只有2种,则L所有可能的结构简式有CH3NHCH3、________________、________________________________________________________________________、
________________。
Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰。按如下路线,由H可合成高聚物V:
H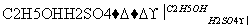 N
N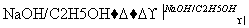 Q
Q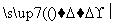 V
V
Mr=167
(5)H的结构简式为________________。
(6)Q→V反应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗曾做过这样一个实验:“一个抽空的密闭容器重M g,在标准状况下,盛满相同物质的量NO和H2的混合气体后,称量为(M+Q) g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的______边托盘上放置______ g砝码。”横线上分别应填的是
A.右 (M+2Q) B.右 (M+4Q)
C.左 (M+2Q) D.左 (M+4Q)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中正确的是( )
A.氢气与氮气能够缓慢地反应生成氨气,使用合适的催化剂可以提高化学反应速率
B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率前者先后都快
C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D.增大反应CO2(g)+H2(g)  CO(g)+H2O(g)的压强,反应速率不变
CO(g)+H2O(g)的压强,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)  H2(g)+I2(g)。若c(HI)由0.1 mol/L降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L降到0.05 mol/L时,所需反应的时间为( )
H2(g)+I2(g)。若c(HI)由0.1 mol/L降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L降到0.05 mol/L时,所需反应的时间为( )
A.等于5 s  B.等于10 s
B.等于10 s
C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO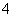 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究________________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的检验、鉴别要特别注意到共存物质的干扰,否则得到的结论就是不可靠的,例如,实验室用乙醇、浓硫酸在170 ℃时制得的CH2===CH2中混有SO2,用溴水或酸性KMnO4溶液检验生成的CH2===CH2时,就要考虑到SO2的影响,因为SO2也能使溴水或酸性KMnO4溶液褪色,所以检验有CH2===CH2生成就需先除去SO2。下列实验设计所得结论可靠的是( )
A.将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成
B.将溴乙烷与NaOH的乙醇溶液共热产生的气体通入到酸性KMnO4溶液中,溶液褪色说明有CH2===CH2生成
C.将溴乙烷与NaOH的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成
D.将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,说明有HBr生成
查看答案和解析>>
科目:高中化学 来源: 题型:
配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是
A.称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转,摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com