



科目:高中化学 来源: 题型:
| A、用酒精代替汽油作汽车燃料 |
| B、随着科技的发展,氢气将会成为主要能源 |
| C、在农村提倡利用沼气作生活燃料 |
| D、人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色
如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | B-H | B-O | B-B |
| 键能(kJ?mol-1) | 389 | 561 | 293 |

查看答案和解析>>
科目:高中化学 来源: 题型:
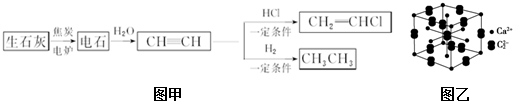
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇 | B、氯仿 | C、乙醛 | D、苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com