
把少量氨气溶于适量的水中,下述不能说明达到电离平衡的是
A.溶液中氮元素的总浓度不再变化
B.溶液中铵根离子的浓度不再变化
C.溶液中氢离子的浓度不再变化
D.溶液中氢氧根离子的浓度不再变化
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:2016-2017学年贵州省遵义市高一上学期期中考试化学试卷 题型:选择题
下列实验设计中能达到预期目的的是
A.将氯化钠和硝酸钾的混合物用溶解、过滤的方法分离
B.将氢气和氧气的混合气体通过灼热的氧化铜除去氢气
C.用碳酸钠溶液鉴别氯化钠溶液、氯化钡溶液及硝酸钙溶液
D.将氯化钾和二氧化锰的混合物用溶解、过滤、蒸发的方法分离
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试化学(文)试卷 题型:选择题
下列过程中,涉及化学变化的是
A.氯气通入水中制氯水
B.四氯化碳萃取碘水中的碘
C.活性炭使红墨水褪色
D.蒸馏法将海水淡化为饮用水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试(理科)化学试卷 题型:实验题
中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
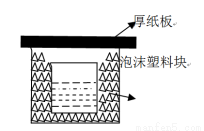
(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于。
(2)倒入NaOH溶液的正确操作是:(从下列选出)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
D.简述测量温度的方法
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=(取到小数点后一位)。
(4)不能用醋酸代替盐酸做此实验,原因是____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试(理科)化学试卷 题型:选择题
在定温定容下的反应:2AB(g) 3A2(g)+B2(g),能说明此反应达到平衡是
3A2(g)+B2(g),能说明此反应达到平衡是
A.混合气体的平均摩尔质量不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成3nmolA2,同时消耗2nmolAB
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试(理科)化学试卷 题型:选择题
下列Q1>Q2的是
A.2H2(g)+O2(g)=2H2O(g)∆H1=-Q1KJ/mol,2H2(g)+O2(g)=2H2O( l)∆H2=-Q2KJ/mol
l)∆H2=-Q2KJ/mol
B.C(金刚石)+O2(g)=CO2(g)∆H1=-Q1KJ/mol,C(石墨)+O2(g)=CO2(g)∆H2=-Q2KJ/mol
C.S(s)+O2(g)=SO2(g)∆H1=-Q1KJ/mol,S(g)+O2(g)=SO2(g)∆H2=-Q2KJ/mol
D.C(金刚石)+0.5O2(g)=CO(g)∆H1=-Q1KJ/mol,C(金刚石)+O2(g)=CO2(g)∆H2=-Q2KJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一10月月考化学试卷(解析版) 题型:选择题
浓盐酸和Ca(ClO)2能发生反应: Ca(ClO)2+4HCl=CaCl2+2H2O+Cl2↑,用久置漂白粉和浓盐酸反应得到的氯气中,可能含有的杂质气体是①CO2,②HCl,③H2O,④O2
A.①②③ B.②③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上学期10月月考化学试卷 题型:选择题
12C原子的质量是ag,某氯原子的质量是bg,用NA表示阿伏加德 罗常数的值,下列说法中错误的是①该氯原子的相对原子质量为12a/b②mg该氯原子的物质的量为m/(bNA)mol③该氯原子的摩尔质量是aNAg④bg该氯原子所含的电子数为17mol
罗常数的值,下列说法中错误的是①该氯原子的相对原子质量为12a/b②mg该氯原子的物质的量为m/(bNA)mol③该氯原子的摩尔质量是aNAg④bg该氯原子所含的电子数为17mol
A.①③
B.②④
C.①②
D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com