
【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |

(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________
【答案】单质 盐 Cu(OH)2 CuO CuSO4 CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu CuSO4+BaCl2=BaSO4↓+CuCl2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl Cu(OH)2![]() CuO+H2O CuO+H2
CuO+H2O CuO+H2![]() Cu+H2O 2Cu+O2
Cu+H2O 2Cu+O2![]() 2CuO
2CuO
【解析】
根据物质的定义判断物质所属类别,根据含有元素的种类及类别写出相应物质的化学式,然后写出符合题意的相应的化学反应方程式。
仅含有Cu元素一种元素的物质是金属Cu单质,则A是单质,B是CuCl2,C是碱,含有Cu元素,则C为Cu(OH)2,D是含有Cu元素的氧化物,D与硫酸反应产生盐,则D为CuO,E是CuO与硫酸反应产生的盐,则E是CuSO4,Cu与Cl2在点燃情况下反应产生CuCl2。
(1)反应①是CuO与稀硫酸反应产生CuSO4、H2O,反应方程式为CuO+H2SO4=CuSO4+H2O;
(2)反应②是CuSO4与Fe反应产生FeSO4、Cu,反应方程式为CuSO4+Fe=FeSO4+Cu;
(3)反应③是CuSO4与金属氯化物反应产生CuCl2,根据复分解反应的规律,金属氯化物为BaCl2,二者反应产生BaSO4沉淀和CuCl2,反应方程式为CuSO4+BaCl2=BaSO4↓+CuCl2;
(4)反应④是CuCl2与碱反应产生Cu(OH)2沉淀,碱可以是NaOH,则该反应方程式为CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(5)反应⑤是Cu(OH)2加热分解产生CuO、H2O,反应方程式为Cu(OH)2![]() CuO+H2O;
CuO+H2O;
(6)反应⑥是CuO与H2在加热条件下反应氧化还原反应产生Cu、H2O,反应方程式为CuO+H2![]() Cu+H2O;
Cu+H2O;
(7)反应⑦是Cu与O2加热产生CuO,反应方程式为:2Cu+O2![]() 2CuO。
2CuO。


科目:高中化学 来源: 题型:
【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热融化但不滴落;D在氧气燃烧,火星四射。根据以上信息回答下列问题:写出对应化学式:
(1)A在室温下与氧气反应生成______,D在空气中锈蚀生成的氧化物为_____。
(2)写出下列化学方程式:
①A在空气中燃烧_______________;
②B长期置于空气中变成绿色物质_________。
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为______,所得溶液中溶质的物质的量浓度为_____(假设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取质量为a g的Fe2O3和CuO的混合固体粉末,进行如下实验:
(1)固体粉末在加热条件下用足量的CO还原,得到金属混合物b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀。则a = ________g(用含b、c的代数式表示)。
(2)固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+,同时收集到224 mL H2(标准状况下),共用去0.03 mol铁粉。则原混合物中Fe2O3的物质的量是________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式________。
(2)实验中第一步所用硫酸浓度为4 mol/L,不能太小,原因是________。
(3)关于该实验过程的下列说法中正确的是________。
A.所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示

B.溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1 mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序________。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净________。
(6)为了测定产品中摩尔盐(M = 392 g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.085 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为________。
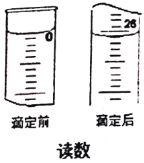
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶未知浓度的Na2S2O3,通过下列实验测定其浓度
①取10.0 mL Na2S2O3于锥形瓶中,滴入指示剂2—3滴。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3 =2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是__________。
(2)步聚③达到滴定终点的判断__________________________________。
(3)己知消耗标准液实验数据如下表:
实验次数 | 始读数(ml) | 末读数(ml) |
1 | 0.10 | 19.20 |
2 | 1.85 | 20.75 |
3 | 0.00 | 24.06 |
则废水中的Na2S2O3物质的量浓度为_______________。
(4) 下列操作会导致测定结果偏高的是_________。
A.滴定管在装液前未用标准溶液润洗
B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关![]() 、
、![]() 系如图中M或N线所示。下列叙述正确的是
系如图中M或N线所示。下列叙述正确的是
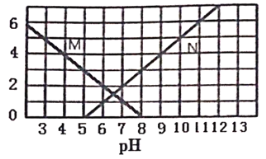
A. M线表示![]() 随pH的变化 B. 若温度升高,两条线均往上平移
随pH的变化 B. 若温度升高,两条线均往上平移
C. BR溶液呈碱性 D. 25℃,0.1 mol/L NaR溶液的pH约为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学新技术与其试图解决的问题不对应的是( )
A.某沿海城市技术开发公司研制的海水淡化膜——资源问题
B.某洗衣机厂研制不用洗衣粉的洗衣机——污染问题
C.研制应用于计算机领域的导电塑料——能源问题
D.中科院研制的纳米玻璃用于国家大剧院——材料问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。下列说法不正确的是
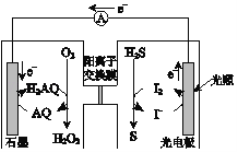
A. 负极的电极反应为2I﹣﹣2e﹣═I2
B. 总反应为 H2S+O2 ![]() H2O2+S
H2O2+S
C. H+通过阳离子交换膜从正极区进入负极区
D. 电源工作时发生了光能、化学能、电能间的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com