
 X、Y、Z、W、R、E是六种短周期元素,如图是这六种元素的主要化合价与其原子序数的关系,下列说法不正确的是( )
X、Y、Z、W、R、E是六种短周期元素,如图是这六种元素的主要化合价与其原子序数的关系,下列说法不正确的是( )| A、原子半径:Z>W>R>E |
| B、R的气态氢化物比X的气态氢化物沸点高 |
| C、Z与Y可形成既含离子键又含共价键的化合物 |
| D、Z的最高价氧化物对应水化物与W的最高价氧化物对应水化物能发生反应 |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、锌锰干电池是一种常用的二次电池 |
| B、氢氧燃料电池比火力发电的能量转变率要高 |
| C、锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D、碱性燃料电池正极反应是O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
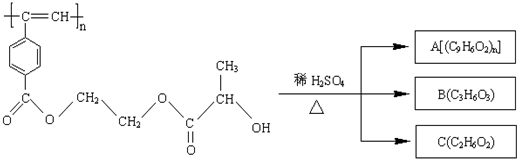
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:C>D |
| B、离子的还原性:B>A |
| C、离子半径:D>C>B |
| D、原子序数:A>C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ClO-、Na+、H+、Cl- |
| B、Mg2+、Cu2+、Cl-、SO42- |
| C、Na+、Ba2+、Cl-、CO32- |
| D、K+、H+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.36L NO2和水反应转移的电子数为0.1NA |
| B、1mol Na2O2与足量的水反应,转移的电子数为2NA |
| C、在常温常压下,1molFe与1molCl2充分反应,转移的电子数约为3NA |
| D、在1L lmol?L-1的氨水中,含有的NH3与NH3?H2O分子的总数小于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com