
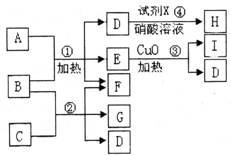
 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下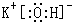 ;试剂X为硝酸银溶液;
;试剂X为硝酸银溶液;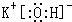 ;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O; 2KCl+3O2↑;
2KCl+3O2↑; 2KCl+3O2↑;分子晶体、离子晶体;
2KCl+3O2↑;分子晶体、离子晶体;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
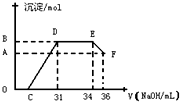 Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.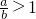 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.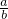 的值为______.
的值为______.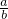 的值为______.
的值为______.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-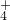 +OH-
+OH- NH3↑+H2O
NH3↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
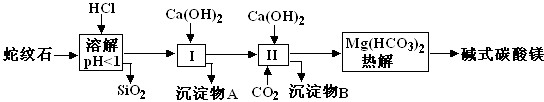
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com