
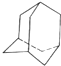
 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:分析 (1)图为有机物结构的键线式,以线代替碳碳键,交点、端点是碳原子,C、H原子不标出,以H原子饱和碳的四价结构,杂原子及杂原子上的H原子应标出;(2)结合有机物的结构书写分子式;
(3)由图中结构可知分子中含有4个六元环,有4个碳原子为三个环共有.氢原子的种类等于一氯代物的种类;
(4)金刚烷中氢有两种:-CH-、-CH2-,利用等效氢,先固定一个氯原子,再移动另一个氯原子,据此判断异构体数目.
解答 解:(1)由图中结构可知,分子中含有10个C原子,三个环共有碳原子上含有1个H原子,为两个六元环共有的碳原子连2个氢原子,故含有的H原子数目为4+6×2=16,故该有机物的分子式为C10H16;故答案为:C10H16;
(2)分子中含有4个六元环,有4个碳原子为三个环共有,故答案为:4;4;
(3)分子中含4个CH,6个CH2,共2种位置的H,所以该物质的一氯代物有2种,故答案为:2;
(4)金刚烷中氢有两种:-CH-、-CH2-,故二氯取代,可以固定一氯,移动另一氯,①固定-CH-,故另一氯可位于六元环的邻、间、对三种,②固定-CH2-,另一可位于同环的1号、3号碳位和异环的-CH2-位,三种,共6种,故答案为:6.
点评 本题考查有机物的结构、性质和化学计算,侧重有机物空间结构的考查,注意碳形成4个化学键及空间对称性是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯酚不慎沾到皮肤上,要先用氢氧化钠溶液清洗,再用水洗 | |
| B. | 被蜜蜂或者蚂蚁蛰了以后痛痒难忍,可以用稀硼酸溶液清洗被蛰处,可减轻痛痒 | |
| C. | 浓硝酸不慎滴到皮肤上,皮肤变成黄色,是因为发生了颜色反应 | |
| D. | 甘油和乙二醇都可以用做抗冻剂,是因为这两个物质的凝固点比较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
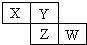 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
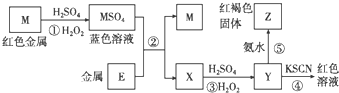
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
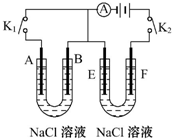 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
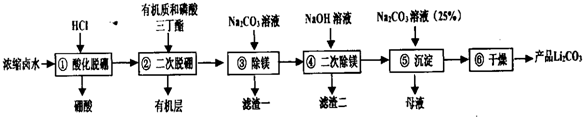
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com