
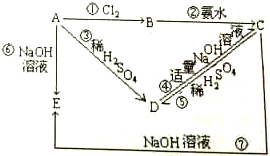
 已知A为金属单质,根据如图物质的变化,回答:
已知A为金属单质,根据如图物质的变化,回答:
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A、原子序数④元素小于⑦元素 |
| B、上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 |
C、⑧号元素离子结构示意图为: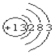 |
| D、②、③处于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
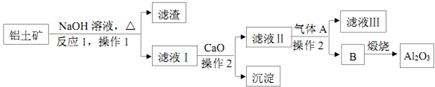
查看答案和解析>>
科目:高中化学 来源: 题型:
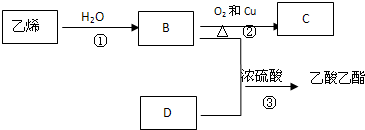
查看答案和解析>>
科目:高中化学 来源: 题型:
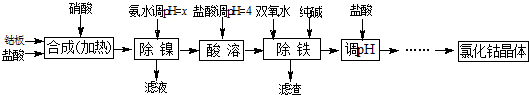
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调pH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、Ba2+、Na+、OH-、SO42- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、K+、Na+、OH-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com