
下列图示与对应的叙述不相符的是
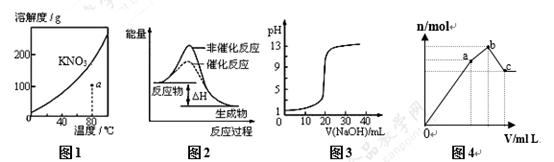
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化、
【知识点】溶解曲线、中和滴定、过量计算
【答案解析】C 解析:A、溶解度曲线下方的点代表未饱和状态,上方的点代表过饱和状态,故A正确; B、催化剂能改变反应所需的最高能垒,加快反应速率,故B正确;
C、0.1000mol•L-1醋酸溶液PH值应大于1,曲线的起始点不应该从1开始,故C错误; D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓;(开始到a)再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3·H2O,所以沉淀质量继续增加;(a到b)继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,(b到c),故D正确。
故答案选C
【思路点拨】本题考查了溶解度、催化剂的作用、酸碱中和滴定、物质间的反应,明确物质的性质及离子反应先后顺序是解本题关键,知道各个拐点溶液中存在的溶质,注意:D选项NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应,为易错点,题目难度较大。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
下列有关的离子方程式正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO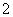 +4NH
+4NH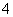
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:Cu+2H+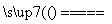 Cu2++H2↑
Cu2++H2↑
C.磷酸一氢钠溶液水解:HPO +H2O
+H2O PO
PO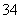 +H3O+
+H3O+
D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,2.24 L Cl2与过量的稀NaOH 溶液反应,转移0.2NA个电子
B.1 mol·L-1 CaCl2溶液含有2NA个Cl-
C.在标准状况下,22.4 L空气中约有NA个气体分子
D.25 ℃时,1 L pH=13的Ba(OH)2溶液中含有0.1NA个Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧0.1 mol两种气态烃的混合物,生成3.58 L CO2(标准状况)和3.6 g H2O,则混合气体中( )
A.一定有甲烷 B.一定有乙烷
C.一定无甲烷 D.一定有丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g) + B(g)=3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
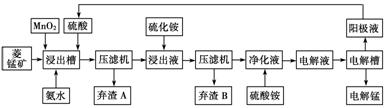
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3[来源:全,品…中&高*考+网] | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
若图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列的说法中正确的是 ( )

A.图2电池在放电过程中,正极区的电极反应为:BH4-— 8e- + 8OH-=BO2- + 6H2O
B.若用稀硫酸浸湿滤纸并用导线将a、b相连,则有电子从b极流出通过导线流向a极
C.若用硫酸钠和紫色石蕊的混合溶液浸湿滤纸并用导线将a、b相连,则可看到铅笔芯C点处浸有紫色石蕊的滤纸变蓝,此处发生电极反应为:O2 + 2H2O+ 4e- = 4OH-
D.若用KI-淀粉溶液浸湿滤纸,同时用导线将a、b分别与A、B电极相连,若看到铅笔芯C点处出现变蓝现象,则b极连接的是燃料电池的A极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com