
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
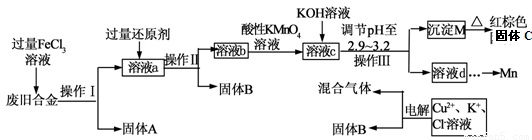
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是????????????????????????????????????? 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:???????????????????? 。
(3)过量的还原剂应是???????????????????????????????????????????????????????? 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为????????????????????? 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为????????????????? g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:????????????? ﹥??????????? ﹥??????????? 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为????? L(用含Z的代数式表示);该电极的反应式为???????????????????????????????????????????????????????????? .
(1)过滤(1分)
(2)2FeCl3 +Fe = 3FeCl2(2分);??? 2FeCl3 + Cu= 2FeCl2 +CuCl2(2分)
(3)Cu粉(2分)???
(4)①? MnO4 - + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O(2分)? ② 0.4XY(2分)
(5)Fe3+ >Cu2+ >Mn2+ (2分)???
(6)22.4Z/64 (2分);? 4OH-? ―4e-=O2↑? + 4H2O(2分)
【解析】
试题分析:根据题给流程图和信息知,废旧合金(含有Cu、Fe、Si 三种成分)与过量FeCl3溶液混合发生的反应为2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2,过滤,固体A的成分为Si,溶液a的成分为FeCl3 、FeCl2 和CuCl2的混合液;电解含Cu2+、Cl—、K+的溶液的固体B,B的成分为Cu;溶液a加过量还原剂反应后过滤得固体B(Cu),则还原剂为铜,发生的反应为2FeCl3 + Cu= 2FeCl2 +CuCl2,溶液b的成分为FeCl2 和CuCl2的混合液;溶液b中加入酸性高锰酸钾溶液,亚铁离子被氧化为铁离子,用氢氧化钾溶液调节溶液的PH,铁离子转化为氢氧化铁沉淀,灼烧的氧化铁,溶液d经处理的金属锰。(1)由流程图知,操作Ⅰ、Ⅱ、Ⅲ为分离固液混合物的操作,指的是过滤;(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2;(3)由上述分析知,过量的还原剂应是Cu粉;(4)①向溶液b中加入酸性KMnO4溶液亚铁离子被氧化为铁离子,反应的离子方程式为MnO4 - + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O;②根据相关反应的关系式:2MnO4 -—— 10Fe2+——5Fe2O3,用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为0.4XYg;(5)根据题意知,溶液c中所含的金属阳离子为Fe3+ 、Cu2+ 和Mn2+,若三者浓度相等,向溶液c中逐滴加入KOH溶液,根据题给溶度积产生判断,Fe3+ 所需氢氧根浓度最小先沉淀,Mn2+所需氢氧根浓度最大,最后沉淀,则三种金属阳离子沉淀的先后顺序为:Fe3+ >Cu2+ >Mn2+;(6)根据题意知,电解过程的电极反应式依次为:阳极:4OH-? ―4e-=O2↑? + 4H2O;阴极:Cu2+ + 2e- = Cu;2H+ + 2e- = H2↑;根据电子守恒计算,标况下阳极生成的最后一种气体体积为22.4Z/64L。
考点:以化学工艺流程为载体考查化学实验基本操作、反应方程式的书写、沉淀溶解平衡及电解计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
【研究课题】 探究草酸晶体受热分解的产物
【查阅资料】 该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)_____________________________________________________。
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】 (1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是___________________________;证明分解产物中有CO的现象是_________________________________________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________________
_____________________________________________________________________。
【交流讨论】 小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
_____________________________________________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年甘肃省兰州一中高二上学期期末考试化学试卷 题型:实验题
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2014届湖南省名校高三第一次大联考化学试卷(解析版) 题型:实验题
现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
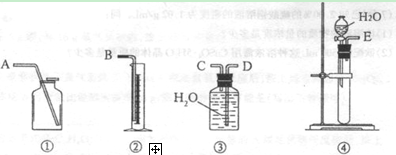
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母):
。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
|
|
读数次数 |
质量/g |
|
锥形瓶+水+试样 |
第1次 |
196.30 |
|
第2次 |
196.15 |
|
|
第3次 |
196.05 |
|
|
第4次 |
196.00 |
|
|
第5次 |
196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是: 。
②此试样中CaC2的质量分数为 。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
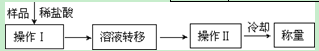
①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:实验题
(12分)某研究性学习小组为测定,13.7g某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:
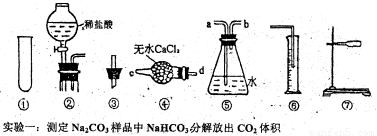
(1)请选择适当的仪器,连接装置的正确顺序是_ 。
(2)加热时NaHC03分解的化学方程式为 。
(3)完成该实验尚缺的玻璃仪器是 (填名称);产生气体从装置④的 进入,从装置⑤的 进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(4)加热后的固体与足量盐酸反应的离子方程式为 。
数据分析及结论:
(5)加入盐酸至无气体产生时,生成CO2体积在标准状况时为2.24L,则Na2CO3样品的纯度为 。
误差分析:
(6)有同学认为实验一⑤中用水会使测量结果产生误差,你认为原因可能是 。
(7)有同学发现在实验—读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com