
| A、稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B、NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C、FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |


科目:高中化学 来源: 题型:
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、生石灰能与水反应,可用干燥氯气 |
| C、维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好 |
| D、氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与乙醇反应时,NH5被氧化 |
| B、NH5中N元素的化合价为+5价 |
| C、1 mol NH5中含有5 molN-H键 |
| D、1 mol NH5与H2O完全反应,转移电子2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol苯分子含有3NA个C-C键 |
| B、一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA |
| C、常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等 |
| D、标准状况下,2.24L CCl4所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于优质合金材料 |
| B、将少量CO2通入CaCl2溶液能生成白色沉淀 |
| C、蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
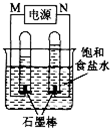 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
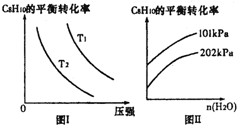 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com