
| A.v正增大,v逆减小 |
| B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 |
| D.v正和v逆不同等程度的减小 |
科目:高中化学 来源:不详 题型:单选题
| A.如果继续通入一定量某气体使体系压强增大,平衡将正向移动 | ||
B.此时,X的正反应速率是Y的逆反应速率的
| ||
| C.如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小 | ||
| D.如果增加X的物质的量,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.减小容器体积,平衡不移动 |
| B.加入催化剂,M的产率增大 |
| C.增大c(P),P的转化率增大 |
| D.降低温度,Q的转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应是吸热反应,m+n<p+q |
| B.逆反应是吸热反应,m+n<p+q |
| C.正反应是吸热反应,m+n>p+q |
| D.逆反应是吸热反应,m+n>p+q |
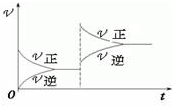
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大压强,化学平衡不一定发生移动(m、p代表任意正整数) |
| B.通入氦气,化学平衡不一定发生移动 |
| C.增加X或Y的物质的量,化学平衡一定发生移动 |
| D.其它条件不变,升高温度,化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑦ | B.①④⑥ | C.②③⑥⑦ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(OH-) | B.pH | C.c(NH4+)/c(NH3·H2O) | D.c(H+)·c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com